Особенности строения, свойства и номенклатура комплексных соединений
Задача 182.
Для приведенных формул комплексных соединений: [Pt(NH3)4Br2]Cl2, [Ni(NH3)6]2[Fe(CN)6].
а) укажите внутреннюю и внешнюю координационные сферы, комплексообразователь и лиганды;
б) определите заряд комплекса, степень окисления и координационное число комплексообразователя;
в) классифицируйте соединения;
г) приведите названия;
д) напишите уравнения первичной и вторичной диссоциации и выражения констант
равновесия.
Решение:
1. [Pt(NH3)4Br2]Cl2
а) внутрення сфера — [Pt(NH3)4Br2]2+, внешня координационная сфера — 2Сl—;
б) заряд комплекса (2+), степень окисления Pt (+4) и координационное число комплексообразователя (6);
в) катионная комплексная соль;
г) дибромотетраамминплатина(IV)хлорид или хлорид дибромоететраамминплатины (IV);
д) уравнение первичной диссоциации:
[Pt(NH3)4Br2]Cl2 = [Pt(NH3)4Br2]2+ + 2Сl—
уравнение вторичной диссоциации:
[Pt(NH3)4Br2]2+ = Pt + 4NH3 + 2Br—
выражение константы равновесия:
Кн = [Pt4+][NH3]4[Br—]2/[[Pt(NH3)4Br2]2+].
Видео:Номенклатура комплексных соединений. 11 класс.Скачать

2. [Ni(NH3)6]2[Fe(CN)6]
а) внутрення сфера — [Fe(CN)6]4-, внутренняя (внешня) координационная сфера — 2[Ni(NH3)6]2+;
б) заряд комплексного аниона (4-), степень окисления Fe (+2) и координационное число комплексообразователя (6); заряд комплексного катиона (2+), степень окисления Ni (+2) и координационное число комплексообразователя (6);
в) двойной (ион-катионный) комплекс;
г) гексацианоферрат(II) 2 гексаамминникеля(II) или гексаамминникеля(II) гексацианоферрат(II)
д) уравнение первичной диссоциации:
[Ni(NH3)6]2[Fe(CN)6] = 2[Ni(NH3)6]2+ + [Fe(CN)6]4-
1) уравнение вторичной диссоциации:
[Ni(NH3)6]2+ = Ni2+ + 6NH3
1) выражение константы равновесия:
Кн = [Ni2+][NH3]6/[[Ni(NH3)6]2+]
2) уравнение вторичной диссоциации:
Видео:Комплексные соединенияСкачать

[Fe(CN)6]4- = Fe2+ + 6CN—
1) выражение константы равновесия:
Кн = [Fe2+][CN—]6/[[Fe(CN)6]4-]
Задача 183.
Надо назвать соединения, определить заряд комплекса и комплексообразователя в следующих соединениях. Написать выражение для константы нестойкости и реакцию диссоциации координационного соединения. Определить тип гибридизации и структурную форму комплекса.
(1.[Co(H2O)6]Cl3; 2.[Pt(H2O)(NH3)Cl2]; 3.Ca[PtCl6]; 4.[Pt(H2O)(NH3)I2].)
Решение:
1. [Co(H2O)6]Cl3
Название — хлорид гексааква хрома (III), заряд комплекса — (3+), заряд комплексообразователя Со — (3+).
Выражение константы нестойкости:
Кн = [Со3+][Н2О]6/[[Co(H2O)6]3+].
Уравнение первичной диссоциации:
[Co(H2O)6]Cl3 = [Co(H2O)6]3+ + 3Сl—
уравнение вторичной диссоциации:
[Co(H2O)6]3+ = Co3+ + 6H2O.
Видео:Комплексные соединения. 1 часть. 11 класс.Скачать

Со3+ имеет d2sp3-гибридизацию.
[Cr(Н2О)6]3+ имеет октаэдрическую конфигурацию.
2.[Pt(H2O)(NH3)Cl2] и 4.[Pt(H2O)(NH3)I2]
всё тоже только в названии вместо дихлоро… нужно дииодо…
дихлороамминакваплатина(II), заряд комплекса — (0), заряд комплексообразователя Pt — (2+).
Кн = [Pt2+][Н2О][NH3][Cl—]2/[Pt(H2O)(NH3)Cl2].
Уравнение диссоциации:
[Pt(H2O)(NH3)Cl2] = Pt2+ + H2O + NH3 + 2Сl—
Pt2+ — dsp2-гибридизация. Плоскоквадратная структура комилекса.
Видео:Комплексные соединения. Строение и классификация. Теория А. Вернера.Скачать

3.Ca[PtCl6]
гексахлороплатинат(IV) кальция, заряд комплекса — (2-), заряд комплексообразователя Pt — (4+).
Выражение константы нестойкости:
Kн = [Pt4+][Cl—]6/[[PtCl6]2-].
Уравнение первичной диссоциации:
Ca[PtCl6] = Ca2+ + [PtCl6]2-
уравнение вторичной диссоциации:
[PtCl6]2- = Pt4+ + 6Cl-.
Pt4+ имеет d2sp3-гибридизацию.
[PtCl6]2- имеет октаэдрическую конфигурацию.
Комплексные ионы
Задача 184.
Как объяснить зеленую окраску раствора комплексного иона [Cu(H2O)2Cl4]2- и фиолетовую окраску раствора комплексного иона [Cu(еn)2]2+?
Решение:
При наличии на d-подуровне в ионе Cu2+ 9 электронов суммарный спин в слабом и сильном поле получается одинаковым. Следовательно, на верхнем энергетическом подуровне имеется вакансия. Переход электронов с t2g на eg подуровень при поглощении кванта света и определяет окраску соединений меди (II). Различная окраска комплексных соединений комплексного иона Cu2+ зависит от характера лигандов. Аквакомплексы меди (П) имеют в водном растворе голубую окраску, введение во внутреннюю сферу комплекса хлорид-ионов приводит к образованию смешанно-лигандного комплекса, что и вызывает изменение окраски раствора на зеленую. Объяснить это можно тем, что слабые лиганды Cl— и H2O. При этом октаэдрический, парамагнитный, внешнеорбитальный (высокопассивный) комплексный ион [Cu(H2O)2Cl4]2- поглощает длину волн видимого спектра в диапозоне 510-550 нм.
Парамагнитный внутриорбитальный ион [Cu(еn)2]2+, образован лигандом сильного поля (еn), имеет линейную геометрическую структуру, гибридизация sp2. Ион [Cu(H2O)2Cl4]2- имеет более высокий параметр поглощения энергии, чем ион [Cu(еn)2]2+ и будет поглощать электромагнитные волны в диапазоне 390 — 440 нм, что и будет обусловливать фиолетовую окраску раствора.
Задача 185.
Даны растворы комплексных ионов с одинаковой молярной концентрацией: [Ni(NH3)4]2+(С1) и [Ni(CN)4]2-(С2). В каком из двух растворов концентрация никеля будет больше? Напишите уравнения вторичной диссоциаци этих комплексных ионов.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Ni(NH3)4]2+ больше чем у иона [Ni(CN)4]2- (9,1•10-8 > 1,0•10-31, то концентрация комплексообразователя (Ni) в растворе [Ni(NH3)4]2+ больше чем в растворе [Ni(CN)4]2-.
[Ni2+](C1) = 9,1 • 10-8 моль/л); [Ni2+](C2) = 1,0 • 10-31 моль/л).
Следовательно, [Ni2+](C1) > [Ni2+](C2).
Вторичная диссоциация комплексных ионов:
Видео:Номенклатура комплексных соединений за 2 минуты для ОГЭ и ЕГЭСкачать

[Ni(NH3)4]2+ = Ni2+(C1) + 4NH3;
[Ni(CN)4]2- = Ni2+(C2) + 4CN—.
Задача 186.
Даны растворы комплексов с одинаковой молярной концентрацией: K2[Cd(CN)4](С1) и Cd[Co(CN)4](С2). Определите концентрации комплексообразователй и лигандов в этих растворах? Составьте схемы полной диссоциации этих комплексов.
Решение:
1. Схемы полной диссоциации комплексов:
K2[Cd(CN)4] = 2K+ + Cd2+ + 4CN—;
Cd[Co(CN)4] = Co2+ + Cd2+ + 4CN—.
2. Определение концентраций комплексообразователей и лигандоов
Так как молярные концентрации комплексных соединений одинаковы, то концентрационными величинами можно пренебречь, тогда
[Cd2+](C1) = 1,4•10-17 моль/л), [CN—](C1) = 4 • 1,4•10-17 моль/л;
[Cd2+](C2) = 7,8•10-6 моль/л), [CN—](C2) = 4 • 7,8•10-6 моль/л.
Выводы:
1) [Cd2+](C2) → [Cd2+](C1);
2) [CN—](C2) → [CN—](C1).
🔥 Видео
Классификация комплексных соединений. 11 класс.Скачать

Свойства комплексных соединений. 11 класс.Скачать

Номенклатура комплексных соединений. Учимся составлять название по формуле.Скачать

Химия. Объяснение темы "Комплексные соединения"Скачать

Лекция комплексные соединенияСкачать

Комплексные соединенияСкачать

Номенклатура комплексных соединений. Строим формулу по названию.Скачать

Комплексные соединения. Определяем заряд комплексного иона и валентность комплексообразователя.Скачать

Комплексные соединения. 2 часть. 11 класс.Скачать

Комплексные соединенияСкачать
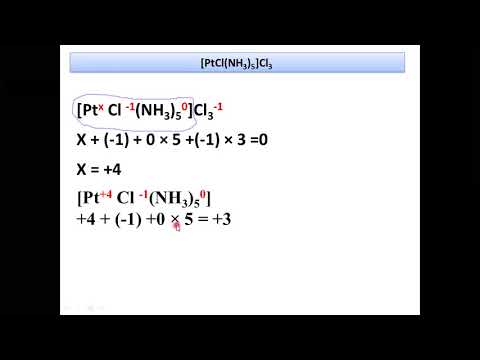
Семинар "Номенклатура комплексных соединений"Скачать

Строение и номенклатура карбонильных соединений. 1 часть. 11 класс.Скачать

Комплексные соединения, 1982Скачать

