Подбор коэффициентов в уравнениях реакций методом полуреакций
Составление уравнений электронного баланса
Задача 121.
Составьте уравнение электронного баланса, расставьте коэффициенты в уравнениях реакций, подберите коэффициенты методом полуреакций в следующих уравнениях:
1) NaNO3 + Mg + H2О = NH3 + Mg(OH)2 + NaOH
2) Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
3) H2S + K2CrO7 + H2SO4 = S + Cr2(SO4)3 + K2SO4 + H2O
Решение:
1) NaNO3 + Mg + H2О= NH3 + Mg(OH)2 + NaOH
Уравнения электронного баланса:
Восстановитель 4|Mg0 — 2электрона = Mg2+ процесс окисления
Окислитель 1|N5+ + 8электронв = N3+ процесс восстановления
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Ионно-молекулярное уравнение:
4Mg0 + N5+ = 4Mg2+ + N3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 8. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
NaNO3 + 4Mg + 6H2О = NH3 + 4Mg(OH)2 + NaOH
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

В данной реакции: Mg – восстановитель, окислитель – NaNO3; Mg окисляется до Mg(OH)2, NaNO3 – восстанавливается до NH3.
2) Na2SO3 + KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Уравнения электронного баланса:
Восстановитель 1|S4+ — 2электрона = S6+ процесс окисления
Окислитель 2|Mn7+ + 1электрон = Mn6+ процесс восстановления
Ионно-молекулярное уравнение:
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

S4+ + 2Mn7+ = S6++ 2Mn6+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 2. Разделив это число на 1, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 2 на 2 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
В данной реакции: Na2SO3 – восстановитель, окислитель – KMnO4; Na2SO3 окисляется до Na2SO4, KMnO4 – восстанавливается до K2MnO4.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

3) K2Cr2O7 + H2S + Н2SO4 = S + Cr2(SO4)3 + K2SO4 + H2O
Уравнения электронного баланса:
Восстановитель 3|S2– — 2электрона = S0 процесс окисления
Окислитель 2|Cr6+ + 3электрона = Cr3+ процесс восстановления
Ионно-молекулярное уравнение:
Видео:Решение ОВР методом полуреакцийСкачать

3S2-+ 2Cr6+ = 3S0 + 2Cr3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
K2Cr2O7 + 3H2S + 4Н2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
В данной реакции: H2S – восстановитель, K2Cr2O7 – окислитель; H2S окисляется до S, K2Cr2O7 – восстанавливается до Cr2(SO4)3.
Формулы амфотерных солей
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Задача 122.
Составьте формулы всех солей соответствующих кислотам и основаниям,
приведенным для вашего задания. (Для амфотерных гидроксидов необходимо составить формулы их солей, образованных как при реакции с кислотами,
так и с основаниями). Приведите реакцию получения одной из солей в молекулярной и сокращенной ионно-молекулярной форме.
NH4OH; Mg(OH)2; HI; H3BO3.
Решение:
1. Для NH4OH:
NH4Cl, (NH4)2SO4, NH4NO3.
2. Для Mg(OH)2 — амфотерный гидроксид:
MgCl2, MgSO4, Mg(NO3)2, MgCO3, MgHCO3, Na2[Mg(OH)4], Sr[Mg(OH)4].
Рреакция получения MgSO4:
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O — молекулярная форма;
2ОН– + 2Н+ = 2H2O — сокращенная ионно-молекулярная форма.
3. Для HCl:
NH4Cl, MgCl2, FeCl2, ZnCl2, FeCl3.
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

4. Для H3BO3 , H[B(OH)4] — амфотерный гидроксид:
Na2B4O7, NaBO3
Реакция получения Na2B4O7:
4B(OH)3 + 2NaOH = Na2B4O7 + 7H2O — молекулярная форма;
7ОН– + 7Н+ = 7H2O — сокращенная ионно-молекулярная форма.
🎬 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Как расставлять коэффициенты в химических реакциях | ОВР | Метод электронного баланса, Химия ЕГЭ, ЦТСкачать

Подбор коэффициентов ОВР "методом полуреакций". Cr2(SO4)3+K2S2O8+H2OСкачать
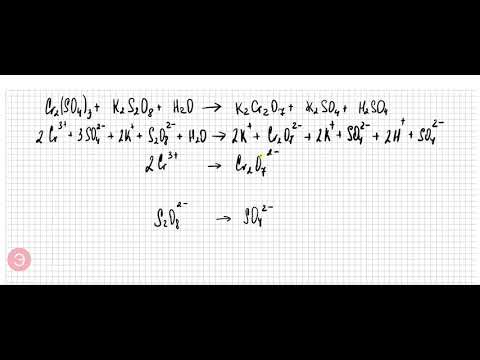
Учимся составлять электронный баланс/овр/8классСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 5ч. 10 класс.Скачать

Метод полуреакций - повторениеСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Задание 20. ОВР и метод электронного баланса - пойми, как это работает | Химия ОГЭ 2023Скачать

