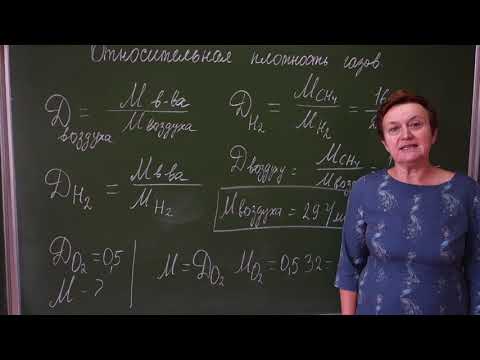- Как правильно решать расчетные задачи по общей химии
- Связывание воды в кристаллогидратах. Дипольные моменты связей в молекулах
- Расчет объемов газов и растворов веществ, участвующих в химических процессах
- Характеристика состояния электрона в атоме с определенным набором квантовых чисел
- Реакции ионного обмена
- Вычисление потери осадка вследствие растворимости
- 📽️ Видео
Как правильно решать расчетные задачи по общей химии
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Связывание воды в кристаллогидратах. Дипольные моменты связей в молекулах
Задача 209.
Как происходит связывание воды в кристаллогидоатах CuSO4•5H2O и SO2 • H2O?
Решение:
а) Катион меди Cu2+ достаточно прочно связывают ближайшие к нему молекулы воды, образуя аквакатион, [Cu(Н2О)4]2+. Кристаллогидраты солей обычно образуются в тех случаях, когда катионы в их кристаллической решетке образуют более прочные связи с молекулами Н2О, чем с анионами в решетке безводной соли. При низких температурах вода в кристаллогидрате CuSO4•5H2O связана и с катионом Cu(2+) и с анионом SO4(2-). С катионом Cu(2+) вода как диполь своими отрицательными полюсами связывается за счет электроститических сил притяжения, при этом катион меди связывает 4 диполя воды, а с анионом SO4(2-) водородными связями, образуя систему [Cu(H2O)4](H2O)SO4 или CuSO4*5H2O, которая устойчива при обычных условиях (— 25 °С и атмосферном давлении).
б) Молекула SO2 имеет треугольную конфигурацию и она полярна, также имеет треугольну конфигурацию полярная молекула воды. Дипольные моменты (µ) молекул SO2 и Н2О, соответственно равны 1,67 D и 1,49 D. Благодаря диполям молекулы SO2 и Н2О, взаимодействия между собой образуют систему SO2 • H2O. Так как дипольные моменты и размеры молекул этих веществ не очень отличны, то они и образуют друг с другом систему SO2 • H2O.
Задача 210.
Зная, что дипольные моменты связей С—Сl и С—Н составляют соответственно 2,2 D и 0,4 D, вычислите дипольный момент хлористого метилена СН2Сl2. Экспериментально определенный дипольный момент равен 1,6 D. Объясните расхождение между экспериментальной и вычисленной величинами, исходя из геометрии молекул.
Решение:
Суммы моментов двух связей С-Н иравна моменту одной связи С-Н, которая была бы расположена на одной оси, в сою очередь сумма мрментов двух связей С-Cl равнанаправлены в противоположные стороныy) получим:
м = м(С-Cl) — м(С-Н) = 2б2 — 0,4 = 1,8 D.
Экспериментально определенный дипольный момент равен 1,6 D, причем отрицательным концом диполя являются атомы Cl, вследствие их большей электроотрицательности. Так как полярность связи С-Н определяется ионной структурой С(+)Н(-), то момент связи С—Cl должен быть равен 2,0 D (0,4 + 1,6 = 2,0). Чтобы найти истинную величину момента связи С—Cl, необходимо знать истинное направление момента свзи С-Н, который до сих пор не опредеден с большой вероятности точностью, в действительности молекула СН2Cl2 имеет форму неправильного тетраэдра. В центре этого неправильного тетраэдра находится атом углерода в состоянии sp3-гибридизации, в углах этого тетраэдра находятся атомы Н и Сl. Причем атомы Сl как более электроотрицательнее оттягивают на себя электронную плотность атома С, который, в свою очередь, оттягивает на себя электронную плотность менне электроотрицательного атома Н. В действительности не происходит полного переноса электронной плотности от более положительного атому к более электротрицательному, т.е. частично заряженные частицы С(+),H(+) Cl(-) продолжают действовать друг на друга. Влияние друг на друга близко расположенных противоположно заряженных астиц вызывает их поляризацию. При сближении или удалении частично заряженных частиц происходит смещение электронной плотности по отношению к ядру и возникает индуцированный дипольный момент (µинд), что и приводит к отклонению расчетных и экспериментальных данных по определению дипольного момента молекулы СН2Cl2.
Экспериментальное значение (µ = 1,6 D) отличается от теоретического (µ = 1,8 D). Это расхождение значений дипольных моментов можно объясняеть тем, что в действительности не происходит полного переноса заряда от катиона к аниону, т.е. ионы продолжают действовать друг на друга.
Влияние друг на друга близко расположенных противоположно заряженных ионов вызывает их поляризацию. При сближении ионов происходит смещение электронной плотности по отношению к ядру и возникает индуцированный дипольный момент (µинд), что и приводит фактически к уменьшению дипольного момента в молекуле вещества.
Видео:Решение задач по общей химии | Химия ЦТ, ЕГЭСкачать

Расчет объемов газов и растворов веществ, участвующих в химических процессах
Задача 211.
Необходимо получить 17 г аммиака. Сколько литров азота и водорода потребуется для этого (выход аммиака составляет 50% от теоритического) и сколько 20 % раствора соляной кислоты необходимо для нейтрализации этого количества аммиака?
Решение:
1. Количество вещества аммиака:
n(NH3) = m(NH3)/M(NH3) = 17/17 = 1 моль.
2. Реакция образования аммиака из водорода и азота идет имеет вид:
N2 + 3H2 = 2NH3.
3. Количество вещества азота, необходимого для реакции:
n(N2) = [0,5•n(NH3)]/0,5 =(0,5 • 1)/0,5 = 1 моль.
4. Объем азота при н. у., ytj,необходимый для реакции:
V(N2) = n(N2)•Vm = 1•22,4 = 22,4 л.
5. Количество вещества водорода, потребного для реакции:
n(H2) = 1,5•n(NH3)/0,5 = 3 моль.
6.Объем водорода при н. у., необходимый для реакции:
V(H2) = n(H2)•Vm = 3•22,4 = 67,2 л.
7. Уравнение реакции нейтрализация аммиака соляной кислотою имеет вид:
NH3 + HCl = NH4Cl.
8 .Количество вещества хлороводорода, необходимого для нейтрализации 1 моль аммиака:
n(HCl) = n(NH3) = 1 моль.
9 .Вес хлороводорода, необходимый для реакции:
m(HCl) = n(HCl)•M(HCl) = 1•36,5=36,5 г.
10. Вес 20%-го раствора соляной кислоты:
m(p-p)=m(HCl)/w%(HCl) = 36,5/0,2 = 182,5 г.
11. По справочным данным плотность (d) 20%-й соляной кислоты составляет 1,0980 г/мл .
12. Объем раствора 20% соляной кислоты: V(p-p)=m(p-p)/d(p-p) = 182,5/1,0980 = 166,2 мл.
Характеристика состояния электрона в атоме с определенным набором квантовых чисел
Задача 212.
1) Охарактеризуйте состояние в атоме электрона с набором квантовых чисел: n = 4; l = 1; m = 0; ms = +1/2.
2) Может ли электрон характеризоваться следующими наборами квантовых чисел:
а) n = 1, l= 2, m = -1, ms = -1/2;
б) n = 2, l= 0, m = 0, ms = -1/2;
в) n = 3, l= 0, m = 1, ms = +1/2;
г) n = 4, l= 3, m = -3, ms = +1/2.
Решение:
1. Охарактеризуйте состояние в атоме электрона с набором квантовых чисел: n = 4; l = 1; m = 0; ms = +1/2.
Значение квантовых чисел на внешнем электроном уровне: n = 4; l = 1; m = 0; ms = +1/2 соответствуют электрону, расположенному на 3d-подуровне, что может характеризовать электронное строение атома галлия.
Электронное строение атома галия
1) электронная формула атома галлия в порядке возрастания энергий орбиталей:
1s22s22p63s23p64s23d104p1
2) электронная формула атома галлия в порядке следования уровней:
1s22s22p63s23p63d104s24p1
3) сокращенная электронная конфигурация Ga:
[Ar]3d104s24p1
У атома данного элемента на внешнем электронном слое на 4р-подуровне находится один неспаренный электрон со спином +1/2. Таким образом, у атома галлия на внешнем энергетическом уровне будет заполнена единственная АО 4s-подуровня и на 4р-подуровня единственный электрон будет находиться на 1-й АО, а остальные две р-орбитали будут не заполнены.
2. Так как n указывает число энергетических уровней, а l — ориентацию АО в пространстве, то на s-подуровне число m имеет единственное значение 0, на р-подуровне оно будет иметь значения -1, 0, +1, на d-подуровне – будет иметь значения -2, -1, 0, +1, +2, на f-подуровне – соответственно -3, -2, -1, 0, +1, +2, +3. Число ms — спин электрона. Он возникает за счёт вращения электрона вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали могут находиться не более двух электронов, различающиеся своими спинами (+1/2) и (-1/2).
а) n = 1, l = 2, m = -1, ms = -1/2.
Этим значениям кваноаых чисел не соответствует характеристика ни одного электрона, так как главному квантовому числу n = 1. соответствует орбитальное квантовое число «l» только со значением «0».
б) n = 2, l = 0, m = 0, ms = -1/2.
Так как n, l определяет ориентацию АО в пространстве, то на s-подуровне m имеет единственное значение 0. Этот набор квантовых чисел может харектирозовать электрон, который находится на 2s-подуровне и имеет левостороннее вращение вокруг своей оси.
в) n = 3, l= 0, m = 1, ms = +1/2.
Так как n, l определяет ориентацию АО в пространстве, то на s-подуровне m имеет единственное значение 0. Этот набор квантовых чисел не может харектирозовать электрон, так как s-лектрон не может находиться на р-орбитали.
г) n = 4, l= 3, m = -3, ms = +1/2.
Так как n, l определяет ориентацию АО в пространстве, то на f-подуровне m имеет значения: -3, -2, -1, 0, +1, +2, +3. Этот набор квантовых чисел может харектирозовать электрон, который находится на 4f-подуровне и имеет правостороннее вращение вокруг своей оси.
Так как n, l определяет ориентацию АО в пространстве, то на s-подуровне число m имеет единственное значение 0, на р-подуровне оно будет иметь значения -1, 0. +1, на d-подуровне – будет иметь значения -2, -1, 0, +1, +2, на f-подуровне – соответственно -3, -2, -1, 0, +1, +2, +3. Число ms — спин электрона. Он возникает за счёт вращения электрона вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали могут находиться не более двух электронов, различающиеся своими спинами (+1/2) и (-1/2).
Реакции ионного обмена
Задача 213.
Напишите реакции ионного обмена (молекуляное уравнение, полное и сокращенное ионное уравнение) для системы:
Al2(SO4)3 + Ba(NO3)2 = ? +
Решение:
Al2(SO4)3 + 3Ba(NO3)2 + 3BaSO4 + 2Al(NO3) — (молекулярное уравнение);
2Al3+ + 3SO42- + 3Ba2+ + 6NO3— = 3BaSO4 + 2Al3+ + 6NO3— (полное ионно-молекулярное уравнение);
3Ba3+ + 3SO42- = 3BaSO4 (сокращенное ионно-молекулярное уравнение).
Вычисление потери осадка вследствие растворимости
Задача 214.
Вычислите массу CaSO4 содержащегося в 200 мл насыщенного водного раствора и в 200 мл 0,025 М раствора H2SO4. В каком из растворов и во сколько раз меньше потери осадка вследствие растворимости?
Решение:
V(СаSO4) = 200 мл = 0,2 л;
M(CaSO4) = 136,1406 г/моль;
ПР(CaSO4) = 2,4 . 10-5.
Уравнение диссоциации CаSO4 имеет вид:
CаSO4 ⇔ Ca2+ + SO42-.
1. Вычисление массы CaSO4 содержащегося в 200 мл насыщенного водного раствора
Обозначим искомую растворимость соли CаSO4 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ca2+ и SO42-.
Выражение произведения растворимости сульфата кальция можно записать как:
ПР(CаSO4) = [Ca2+] • [SO42-] = S * S = S2.
Отсюда
S = 2,4 . 10-5 = 4,9 . 10-3 моль/л.
Рассчитаем массу СаSO4 в 200 мл раствора, учитывая, что M(СаSO4) = 136,1406 г/моль, получим:
m(СаSO4) = S • M(СаSO4) • V(СаSO4) = [(4,9 . 10-3 моль/л) • 136,1406 г/моль) • 0,2 л] = 0,1334 г.
2. Вычисление массы CaSO4 содержащегося в в 200 мл 0,025 М раствора H2SO4
Пусть S — растворимость CaSO4 в данных условиях, тогда S = [Ca2+]. Однако концентрация cульфат-ионов в растворе [SO42-] = S + 0,025. Первое слагаемое показывает, какую концентрацию ионов создает сульфат кальция, а второе — серная кислота. Если S << 0,1,то [SO42-] = 0,025 моль/л, тогда
S’(CaSO4) = S • 0,025 = (4,9 . 10-3) • 0,025 = 0,0001225 = 1,225 . 10-4 моль/л.
Рассчитаем массу СаSO4 в 200 мл раствора, учитывая, что M(СаSO4) = 136,1406 г/моль, получим:
m'(СаSO4) = S • M(СаSO4) • V(СаSO4) = [(1,225 . 10-4 моль/л) • 136,1406 г/моль) • 0,2 л] = 0,0033 г.
Ответ: m(СаSO4) = 0,1334 г; m'(СаSO4) = 0,0033 г.
Задача 215.
В жаркий летний день Игорь достал из холодильника бутылку сладкого газированного напитка, сделал несколько глотков и оставил ее на столе, не закрыв. Через некоторое время напиток показался ему не таким вкусным. Что произошло? Поясните, почему.
Решение:
Потому что при производстве газированных напитков используется угольная кислота (углекислый газ), образуется раствор, насыщенной углекислым газом. А в результате открытия бутылки пароисходит разрушение углекислоты, что сопровождается выделением СО2. Также в открытую бутылку проникет кислород из воздуха, что приводит к частчному окислению ароматизаторов и других веществ, а это сказывается на изменении вкуса газированного напитка.
📽️ Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как решать ЗАДАЧИ по ХИМИИ? Химия с нуляСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать

Как научиться решать расчетные задачи ЕГЭ по химии? | Екатерина Строганова | 100балльный репетиторСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ. Часть 1.Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Вся практика по общей химии за 6 часов для ЕГЭ| Екатерина СтрогановаСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

2 ГЛАВНЫХ формулы в Химии при решении задачСкачать

Решение задач на концентрации растворовСкачать

Повторяем все задачи на ОГЭ по химии | Химия ОГЭ 2023 | УмскулСкачать

КАК РЕШАТЬ ЕГЭ ПО ХИМИИ? — Задачи на избыток и недостаток #shorts #youtubeshortsСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать