Решение задач на вычисление энергии связи (binding energy) в молекуле
Рассчитайте энергию связи в оксиде фтора
Задача 136.
Теплота образования F2O из простых веществ при стандартных условиях составляет 22 КДж/моль. Рассчитайте энергию связи O-F в молекуле фторида кислорода,если энергия связей в молекулах O2 и F2 составляет соответственно 498 и 159 КДж/моль.
Решение:
Уравнение реакции образования оксида фтора имеет вид:
2F2 + O2 — 2F2O
Образование двух молекул F2O можно представить как последовательный процесс разрыва связей F-F в молекуле F2 и связей
O-O в молекуле O2:
Видео:Дефект массы и энергия связи(видео 16) | Квантовая физика | ФизикаСкачать

2F-F→ 4F* → 2D(F-F)
O-O → 2O* → D(O-O)
4F* + 2O* → 2F2O + 4D(O-F), где
D(F-F), D(O-O) и D(O-F) – энергии образования связей F-F, O-O и O-F, соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению:
2F2(г) + O2(г) = 2F2O(г) → 2D(F-F) – D(O-O) + 4D(F-O).
Видео:Решение задач на вычисление энергии Гиббса. 2 часть. 10 класс.Скачать
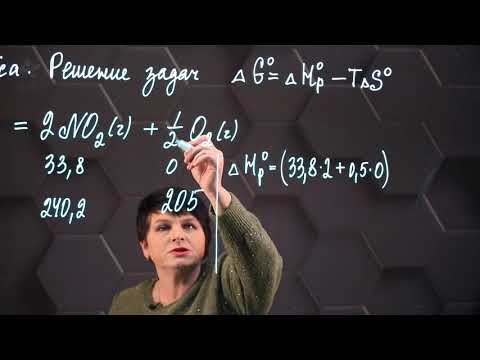
Согласно закону Гесса тепловой эффект этой реакции равен:
2Q = –2D(F-F) – D(O-O) + 4D(F-O),
откуда
D(O-F) = [2Q + 2D(F-F) + D(O-O)]/4 = [44 + (2 . 159) + 498]/4 = 215 кДж/моль.
Вычисление энергии связи H-S в молекуле H2S
Задача 137.
Вычислите энергию связи H-S в молекуле H2S по следующим данным: 2H2 (г) + S2(г) = 2H2S (г) – 40,30 кДж; энергии связей D(H-H) и D(S-S) соответственно равны –435,9 кДж/моль и – 417,6 кДж/моль.
Решение.
Образование двух молекул H2S можно представить как последовательный процесс разрыва связей H-H в молекуле H2 и связей S-S в молекуле S2:
Видео:Решение задач на вычисление энергии Гиббса. 1 часть. 10 класс.Скачать

2H-H 4Н – 2D(H-H)
S-S 2S – D(S-S)
4Н + 2S 2H2S + 4D(S-H),
где D(H-H), D(S-S) и D(S-H) – энергии образования связей H-H, S-S и S-Н, соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению:
2H2(г) + S2(г) = 2H2S(г) –2D(H-H) – D(S-S) + 4D(S-H).
Видео:9 класс. Энергия связи. Дефект массыСкачать

Тепловой эффект этой реакции равен:
2Q = –2D(H-H) – D(S-S) + 4D(S-H), откуда
D(S-H) = [2Q + 2D(H-H) + D(S-S)]/4 = [(2 . 40,30) + (2 . –435,9) + 417,6]/4 = 232,43 кДж/моль.
Расчет энергии связи N-H в молекуле аммиака
Задача 138.
Стандартная энтальпия образования NH3 составляет 46 кДж/моль. Рассчитайте энергию связи N-H в молекуле аммиака, если энергии связей в молекулах H2 и N2 составляют соответственно 436 и 945 кДж/моль.
Решение:
Уравнение реакции образования оксида фтора имеет вид:
3Н2 + N2 — 2NH3
Видео:Урок 471. Ядерные реакции. Энергетический выход ядерной реакцииСкачать

Образование двух молекул NH3 можно представить как последовательный процесс разрыва связей H-H в молекуле H2 и связей N-N в молекуле N2:
3H-H → 6H* → 3D(H-H)
N-N → 2N* → D(N-N)
6H* + 2N* → 2NH3 + 6D(H-N), где
D(H-H), D(N-N) и D(H-N) – энергии образования связей F-F, O-O и O-F, соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению:
Видео:Физика -Как найти энергию связи. Выполнялка 98Скачать

3H2(г) + N2(г) = 2NH3(г) → 3D(H-H) – D(N-N) + 6D(H-N).
Согласно закону Гесса тепловой эфaект этой реакции равен:
2Q = –NH3 – D(N-N) + 6D(H-N),
откуда
D(H-N) = [2Q + 3D(H-H) + D(N-N)]/6 = [(2 . 46) + (3 . 436) + 945]/6 = 390 кДж/моль.
💥 Видео
Урок 168. Задачи на вычисление внутренней энергииСкачать

Дефект масс, энергия связи атомных ядер (решение задач)Скачать

Строение атома. Энергия связи. Подготовка к ЕГЭ по физике | Николай Ньютон. ТехноскулСкачать

Ядерное взаимодействие, ядерные силы. Дефект масс, энергия связи атомных ядер. 1 часть. 9 класс.Скачать

Закон сохранения энергии. 9 класс. Решение задачСкачать

Урок 154. Задачи на вычисление скорости молекулСкачать

Алгоритм решения задач на Закон сохранения энергииСкачать

Метод молекулярных орбиталей (химическая связь, часть 3)Скачать

ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ в механике класс физика ПерышкинСкачать

7 класс. Решение задач по теме "ЭНЕРГИЯ"Скачать

Потенциальная и кинетическая энергияСкачать

Расчет энергии связи атомного ядра на примере золотаСкачать
10 класс урок №34 Температура как мера средней кинетической энергии теплового движения молекулСкачать

Энергия. Кинетическая и потенциальная энергия. Практическая часть. 7 класс.Скачать

