Рассчеты, связанные с приготовлением буферных растворов
Вычисление буферной емкости по кислоте
Задача 51.
Какова буферная емкость по кислоте, если прибавление к 80 мл буферного раствора 30 мл 0,1 М раствора HCl вызвало изменение pH на единицу?
Решение:
Буферная емкость (buffer capacity) ß – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу. Буферную емкость рассчитывают по уравнению:
ß = n/(z • V • ∆pH)
HCl — кислота одноосновная, поэтому z = 1:
n(HCl) = CV = 0,030 • 0,1 = 0,003 моль;
V(буфера) = 0,08 л
ß = 0,003/(1 • 0.08 • 1) = 0,0375 моль/л.
Видео:Буферные растворы. 1 часть. 11 класс.Скачать

Ответ: ß = 0,0375 моль-экв/л.
Вычисление рН буферного раствора
Задача 52.
Вычислите рН раствора, полученного при смешивании 29 см3 6,2 Н. раствора уксусной кислоты и 1 см3 2,0 Н. раствора ацетата натрия.
Решение:
Получается буферный раствор — смесь слабой кислоты и ее соли (анионов слабой кислоты):
рН = рКа + lg[CM(соли)/CM(кислоты)];
CM = СH/z, где z — число эквивалентности.
Для кислоты z равно основности, для соли — числу катионов или анионов, умноженному на заряд соответствующего иона.
Уксусная кислота — одноосновная, поэтому z = 1.
В формуле ацетата натрия имеется по 1 иону с единичным зарядом, поэтому z = 1.
Соответственно, для обоих веществ СН = СМ.
При смешивании раствора получен буферный раствор объемом 29 + 1 = 30 мл = 0,03 л.
С1V1 = C2V2, отсюда:
См(СН3СООNa) = С1V1/V2(буф. p-pa) = (6,2 • 0,029)/0,03 = 5,99 М;
См(CH3COOH) = С1V1/V2(буф.) = (2 • 0,001)/0,03 = 0,067 М;
рК(СН3СООН) = 4,76;
рН = 4,76 + lg(5,99/0,067) = 4,76 + lg89,4 = 4,76 + 1,95 = 6,71.
Ответ: рН = 6,71.
Расчет количества (моль) одноосновной кислоты
Видео:Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Задача 53.
Какое количество (моль) одноосновной кислоты необходимо ввести больному с рН крови 7,6 объемом 4л и буферной емкостью по кислоте 0,06 моль/л для нормализации рН крови?
Решение:
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40. Рассчет будем производить по формуле:
ß = n/(z • V • ∆pH), где
ß — буферная емкость, n — количество вещества кислоты или соли, z — основность кислоты, V — объем раствора, ∆pH — изменене системы.
ß = 0,06 моль/л;
z = 1, потому что кислота одноосновная;
∆pH = (7,6 — 7,4) = 0,2;
V = 4л.
Рассчитаем количество (моль) одноосновной кислоты, получим:
ß = n/(z • V • ∆pH);
n(кислоты) = ß • (z • V • ∆pH) = 0,06 моль/л • (1 • 4 л •0,2) = 0,048 моль.
Ответ: n(кислоты) = 0,048 моль.
📺 Видео
Буферные растворы. Практическая часть. 11 класс.Скачать

Связь pH и pKa для буферных растворов (видео 6) | Буферные растворы | ХимияСкачать
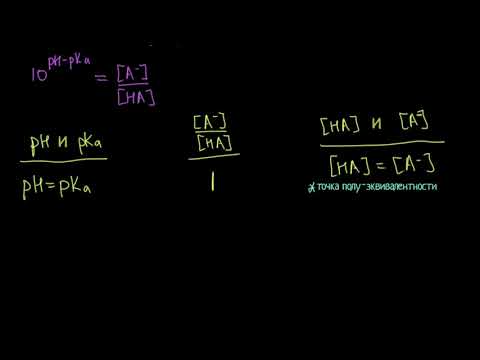
Приготовление раствора с заданной концентрациейСкачать

Расчеты pH буферных растворовСкачать

Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

Приготовление буферных растворов / Preparation of buffer solutionsСкачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Буферная ёмкость (видео 7) | Буферные растворы | ХимияСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

pH и буферные растворы | Медицинская химия | МедвузаСкачать

Буферные растворы. 2 часть. 11 класс.Скачать

Определение концентрации вещества в растворе методом титриметрииСкачать

Вывод формулы для расчета pH буферного раствораСкачать

Введение в буферные растворы (видео 1) | Буферные растворы | ХимияСкачать

Буферные растворыСкачать

3 5 Буферные растворыСкачать

Расчеты pH буферных растворов 2Скачать

