Как правильно рассчитать молярность кислот по значению рН их растворов
Задача 90.
Вычислите молярность раствора НСООН, имеющего рН 3,0.
Решение:
рН = 3,0;
КD(НСООН) = 1,77 · 10–4.
Водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе:
рН = -lg[H+]
Пусть искомая концентрация ионов водорода будет «х«. Тогда, учитывая, что pH раствора 3,0, найдем концентрацию ионов водорода в этом растворе:
-lg[H+] = -lgx = 3,0
Тогда
х = 1 · 10–3.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Таким образом,концентрация ионов водорода в растворе равна 1 · 10–3 моль/дм3.
Концентрации ионов [H+] и ионов [НCOO—] в растворе НCOOH равны:
НCOOH ⇔ НCOO— + H+
Обозначим искомую концентрацию уксусной кислоты через «у» и найдём его значение из выражения константы диссоциации, получим:
КD(НСООН) = [H+][НCOO—]/[НCOOH];
1,77 · 10–4 = (1 · 10–3)2/у;
у = (1 · 10–3)2/(1,77 · 10–4) = 5,65 · 10–3 моль/дм3.
Ответ: СМ(НСООН) = 5,65 · 10–3 моль/дм3.
Задача 91.
Определите молярность раствора НСN, имеющего рН 5,0.
Решение:
рН = 5,0;
КD(НСN) = 7,90 · 10–10.
Водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе:
Видео:Молярная концентрация. 10 класс.Скачать

рН = -lg[H+]
Пусть искомая концентрация ионов водорода будет «х«. Тогда, учитывая, что pH раствора 5,0, найдем концентрацию ионов водорода в этом растворе:
-lg[H+] = -lgx = 5,0
Тогда
х = 1 · 10–5.
Таким образом, концентрация ионов водорода в растворе равна 1 · 10–5 моль/дм3.
Концентрации ионов [H+] и ионов [CN—] в растворе НСN равны:
НСN ⇔ СN— + H+
Обозначим искомую концентрацию уксусной кислоты через «у» и найдём его значение из выражения константы диссоциации, получим:
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

КD(НСN) = [H+][CN—]/[НСN];
7,90 · 10–10 = (1 · 10–5)2/у;
у = (1 · 10–5)2/(7,90 · 10–10) = 0,127 моль/дм3.
Ответ: СМ(НСN) = 0,127 моль/дм3.
Задача 92.
Определите молярность раствора СН3СООН, имеющего рН 4,0.
Решение:
рН = 4,0;
КDСН3СООН) = 1,78 · 10–5.
Водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе:
рН = -lg[H+]
Пусть искомая концентрация ионов водорода будет «х«. Тогда, учитывая, что pH раствора 4,0, найдем концентрацию ионов водорода в этом растворе:
-lg[H+] = -lgx = 4,0
Тогда
Видео:pH и pOH сильных кислот и оснований (видео 5)| Кислоты и Основания | ХимияСкачать
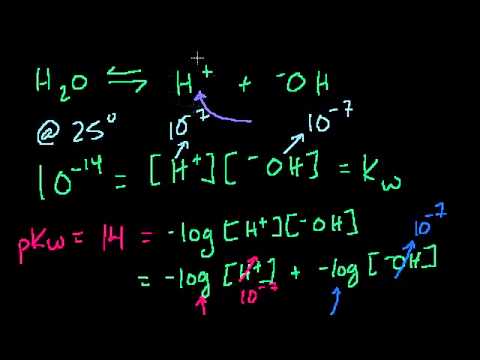
х = 1 · 10–4.
Таким образом,концентрация ионов водорода в растворе равна 1 · 10–4 моль/дм3.
Концентрации ионов [H+] и ионов [СН3СОО—] в растворе СН3СООН равны:
СН3СООН ⇔ СН3СОО— + H+
Обозначим искомую концентрацию уксусной кислоты через «у» и найдём его значение из выражения константы диссоциации, получим:
КD(СН3СООН) = [H+][СН3СОО—]/[СН3СООН];
1,78 · 10–5 = (1 · 10–4)2/у;
у = (1 · 10–4)2/(1,78 · 10–5) = 5,6 моль/дм3.
Ответ: СМ(СН3СООН) = 5,6 моль/дм3.
Задача 93.
Вычислите молярность раствора C2H5COOH, имеющего рН 3,2.
Решение:
рН = 3,2;
КD(C2H5COOH) = 1,40 · 10–4.
Видео:Способы выражения концентрации растворов. 8 класс.Скачать

Водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе:
рН = -lg[H+]
Пусть искомая концентрация ионов водорода будет «х«. Тогда, учитывая, что pH раствора 3,2, найдем концентрацию ионов водорода в этом растворе:
-lg[H+] = -lgx = 3,2
Тогда
х = 6,3 · 10–4.
Таким образом,концентрация ионов водорода в растворе равна 6,3 · 10–4 моль/дм3.
Концентрации ионов [H+] и ионов [C2H5COO—] в растворе C2H5COOH равны:
C2H5COOH ⇔ C2H5COO— + H+
Видео:Приготовление раствора с заданной концентрациейСкачать

Обозначим искомую концентрацию уксусной кислоты через «у» и найдём его значение из выражения константы диссоциации, получим:
КD(C2H5COOH) = [H+][C2H5COO—]/[C2H5COOH];
1,40 · 10–4 = (6,3 · 10–4)2/у;
у = (6,3 · 10–4)2/(1,40 · 10–4) = 2,84 · 10–3 моль/дм3.
Ответ: СМ([C2H5COOH) = 2,84 · 10–3 моль/дм3.
🎬 Видео
ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

4.Молярность и нормальность растворов. Подготовка к олипиадам по химии 8-9 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])Скачать
![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)
Расчет рН растворов сильных и слабых оснований. Химия для поступающих.Скачать

Буферные растворы. 1 часть. 11 класс.Скачать

Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Определение концентрации вещества в растворе методом титриметрииСкачать

Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])Скачать
![Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])](https://i.ytimg.com/vi/0qTq4bM0zHk/0.jpg)
Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Особые случаи pH растворов. Решение задач на рН.Скачать

Нормальная концентрация раствора. Нормальность (Сн). Решение задач.Скачать

