- Как правильно вычислить аналитический множитель (фактор пересчета) для оксидов
- Вычисление аналитического множителя для определяемого вещества К2О и весовой формы K2PtCl6
- Вычисление аналитического множителя для определяемого вещества Ag2О и весовой формы AgCl
- Вычисление аналитического множителя для определяемого вещества Ag и весовой формы AgCl
- 🎥 Видео
Как правильно вычислить аналитический множитель (фактор пересчета) для оксидов
Вычисление аналитического множителя для определяемого вещества К2О и весовой формы K2PtCl6
Задача 306.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество К2О; весовая форма K2PtCl6.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (K2O) и гравиметрической (весовой) формы (K2PtCl6), то аналитический множитель будет иметь следующее значение:
f = Мr(K2O)/Mr(K2PtCl6) = 94,196/485,994 = 0,1938,
где Мr(K2O) = 94,196; Mr(K2PtCl6) = 485,994.
Ответ: f = 0,1938.
Вычисление аналитического множителя для определяемого вещества Ag2О и весовой формы AgCl
Задача 307.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Ag2О; весовая форма AgCl.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Ag2O) и гравиметрической (весовой) формы (AgCl), то аналитический множитель будет иметь следующее значение:
f = Мr(Ag2O)/2Mr(AgCl) = 231,736/(2 . 143,321) = 0,8085,
где Мr(Ag2O) = 231,736; Mr(AgCl) = 143,321.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Ответ: f = 0,8085.
Вычисление аналитического множителя для определяемого вещества Ag и весовой формы AgCl
Задача 308.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Ag; весовая форма AgCl.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Ag) и гравиметрической (весовой) формы (AgCl), то аналитический множитель будет иметь следующее значение:
f = Аr(Ag)/Mr(AgCl) = 107,868/143,321 = 0,7526,
где Аr(Ag) = 107,868; Mr(AgCl) = 143,321.
Ответ: f = 0,7526.
Вычисление аналитического множителя для определяемого вещества Cl— и весовой формы AgCl
Задача 309.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Cl—; весовая форма AgCl.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Cl—) и гравиметрической (весовой) формы (AgCl), то аналитический множитель будет иметь следующее значение:
f = Мr(Cl—)/Mr(AgCl) = 35,453/143,321 = 0,2474,
где Мr(Cl—) = 35,453; Mr(AgCl) = 143,321.
Ответ: f = 0,2474.
Вычисление аналитического множителя для определяемого вещества MgO и весовой формы Mg2P2O7
Задача 310.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество MgO; весовая форма Mg2P2O7.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (MgO) и гравиметрической (весовой) формы (Mg2P2O7), то аналитический множитель будет иметь следующее значение:
f = 2Мr(MgO)/Mr(Mg2P2O7) = (2 . 40,305)/222,558 = 0,3622,
где Мr(MgO) = 40,305; Mr(Mg2P2O7) = 222,558.
Ответ: f = 0,3622.
🎥 Видео
ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Составление формулы оксидов. ПримерСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Оксиды. 1 часть. 8 класс.Скачать
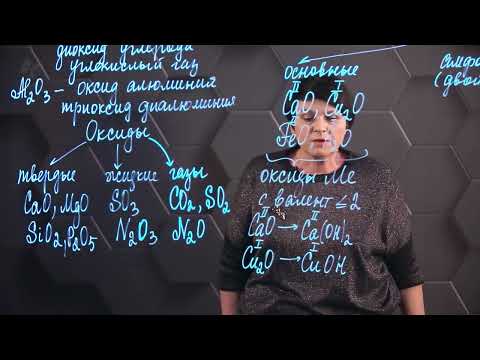
Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Химия 8 класс (Урок№16 - Свойства, получение, применение оксидов.)Скачать

Алгоритм решения расчетных задач в аналитической химии.Скачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Типы оксидов за 2 минуты (8 классам)Скачать
Важнейшие классы неорганических соединений. Тема 11. Получение и применение оксидовСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ВСЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ ДЛЯ ЕГЭ ПО ХИМИИ 2024! | Химический сериал, 2 выпускСкачать

Оксиды. 2 часть. 8 класс.Скачать

СВОЙСТВА ОСНОВНЫХ ОКСИДОВ для ЕГЭ по химии | Химический сериал, 1 выпускСкачать

Химия 8 класс (Урок№15 - Оксиды: классификация, номенклатура.)Скачать

Оксиды. Практическая часть. 8 класс.Скачать

Характеристика и химические свойства оксидов | Химия ЕГЭ 10 класс | УмскулСкачать

8 класс. Кислотные оксиды.Скачать

