- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- 📹 Видео
Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
Видео:Степень гидролиза и как её рассчитатьСкачать

S2– + HOH = HS– + OH– — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
2CuSO4 + 2H2O = (CuOH)2SO4 + H2SO4 — (молекулярная форма);
Cu2+ + HOH = CuOH+ + H+ — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Видео:Константа гидролиза и pH водного раствора солиСкачать

Al3+ + 3CH3COO– + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN– + HOH ⇔ HCN + OH–
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kr = Kw/KD(кислоты)
Kw = 1 . 10-14 – ионное произведение воды.
Видео:Гидролиз солей. 9 класс.Скачать

KD(HCN) = 5 . 10-10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10-14)/(5 . 10-10) = 2 . 10-5.
Находим степень гидролиза цианида калия, получим:
Видео:№ 76. Неорганическая химия. Тема 9. Гидролиз солей. Часть 5. Константа гидролиза солейСкачать

Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
Видео:Вычисление рН в растворах солейСкачать

[OH–] = h . СM(KCN) = (4 . 10-3) . 0,005 = 2 . 10-5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH–] = – lg2 . 10-5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

рН = 14 – рОН = 14 – 4,7 = 9,3.
Ответ: рН = 9,3.
📹 Видео
ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

11 класс. Гидролиз солей.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз Разбор задачиСкачать
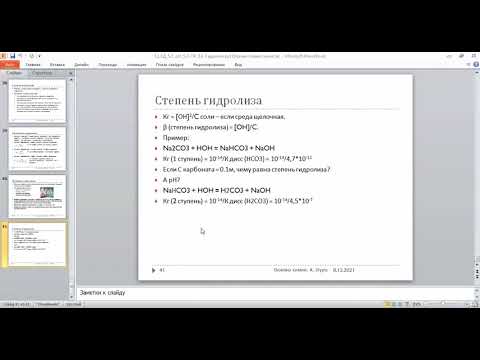
Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

pH раствора солиСкачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

№ 86. Неорганическая химия. Тема 10. Электролитическая диссоциация. Часть 7. Константа диссоциацииСкачать

