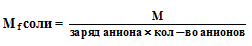Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия как «эквивалент» и установлению закона эквивалентов: «Массы взаимодействующих без остатка веществ относятся как их эквивалентные массы».
Эквивалент – это реальная или условная частица (атом, молекула…) или часть частицы, которая реагирует (соединяется, замещает, отрывается) с одним атомом водорода, половиной атома кислорода, одним электроном или эквивалентными им частицами. Например, атом водорода в воде (Н2О) прореагировал с 1/2 атома кислорода; эквивалент кислорода составляет 1/2 его атома. Для расчетов само понятие эквивалента не используется, для этого используют следующие величины.
Фактор эквивалентности — f — часть частицы, составляющей один эквивалент; f принимает значение 1, 1/2, 1/3, и т.д. Показатель эквивалентности Z = 1/f (он равен стехиометрической валентности).
Эквивалентная масса или масса моль эквивалентов (Mf, Af) измеряется в граммах или в а.е.м. (относительная Mr). Молярная масса эквивалентов вещества в конкретной реакции всегда в Z раз меньше молярной массы этого вещества.
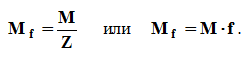
Непосредственно из понятия эквивалента следует необходимость важнейшего понятия химии – валентность (от Valentia – сила) – это способность атома присоединять к себе определенное число других атомов.
Стехиометрическая валентность атома (Vстх) отражает состав вещества (без учета строения и структуры):
Например, при взаимодействии серы с водородом образуется Н2S; эквивалент серы равен 1/2 атома (f(S) = 1/2); Аr(S) = 32:
Видео:Эквивалент и закон эквивалентовСкачать

Математическое выражение закона эквивалентов:
Рассмотрим примеры решения задач на закон эквивалентов:
Пример 1.
Определить эквивалент и эквивалентные массы гидроксида висмута (III) в реакциях:
1) Bi(OH)3 + HCl = Bi(OH)2Cl + Н2O;
2) Bi(OH)3 + 3HCl = BiCl3 + H2O.
Решение:
1) f(Bi(OH)3) = 1, Mf(Bi(OH)3) = 260 г/моль (т. к. из трех групп заместилась одна);
2) f(Bi(OH)3) = 1/3, a Mf(Bi(OH)3) = 260 /3 = 86,3 г/моль (т.к. из трех групп заместились все три).
Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Так, f(Al2(SO4)3) = 1/3.2 = 1/6. Однако в реакции эта величина может быть больше (неполное замещение) или меньше (комплексообразование). Если, например, это соединение участвует во взаимодействии по реакции:
Видео:Эквивалент. Часть 1. Эквивалент элемента. Задачи.Скачать

(Al2(SO4)3) + 12KOH = 2K3[Al(OH)6] + 3K2SO4,
то при этом три аниона с суммарным зарядом 6 замещаются 12 ОН— группами, следовательно 12 эквивалентов этого вещества должно вступать в реакцию, таким образом f(Al2(SO4)3) = 1/12.
Эквивалентная масса оксида в реакциях полного замещения равна:
Так, f(Fe2O3) = 1/3.2 = 1/6. Мf =
= М(Fe2O3).f(Fe2O3) = 160.1/6 = 26,6 г.
Однако в реакции:
Видео:Как применять закон эквивалентов в решении задачСкачать

Fe2O3 + 4HCl = 2FeOHCl2 + H2O f(Fe2O3) = 1/4, т. к.
Fe2O3 взаимодействует с 4 эквивалентами HCl;
Мf = 160/4 = 40г.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним моль эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 литров (молярный объем Н2 составляет 22,4 л, а так как Мf (Н) = 1г, то эквивалентный объем будет в 2 раза меньше молярного, т. е. 11,2 л.). Пример 2.1,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
Ответ: 9г/моль; 79,9г/моль.
📹 Видео
Что такое эквивалент?Скачать
Решение задач на эквивалентыСкачать

133. Эквивалент. Молярная масса эквивалента.Скачать

Задачка на закон эквивалентовСкачать

Эквиваленты Закон эквивалентовСкачать

Как найти формулу вещества, используя закон эквивалентовСкачать

№ 148. Неорганическая химия. Тема 17. Основные законы химии. Часть 3. Закон эквивалентовСкачать

Химический эквивалентСкачать
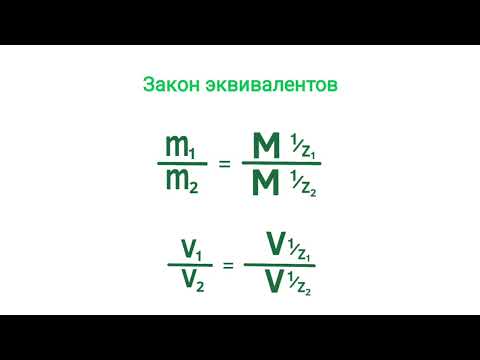
Химический эквивалент и фактор эквивалентности в реакциях ионного обменаСкачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

ЭквивалентСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Эквивалент. Часть 2. Эквивалент сложного в-ва: оксидов, оснований, кислот, солей.Скачать

Эквивалент. Часть 4. Задачи на эквивалент в окислительно-восстановительных реакциях.Скачать

132. Фактор эквивалентности. Число эквивалентности.Скачать

Нормальная концентрация раствора. Нормальность (Сн). Решение задач.Скачать

Тема: Закон ЭквивалентовСкачать