Выражения скорости и константы равновесия химической реакции
Скорости прямой и обратной реакци разложения СО
Задача 128
Выразите через концентрации скорости прямой и обратной реакций и константу равновесия для системы:
2CO(г) <=> CO2(г) + С(т), ∆Н < 0.
Куда сместится равновесие при: а) при повышении температуры; б) при понижении давления; в) при понижении концентрации CO2?
Решение:
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

1. Выражение для прямой и обратной реакции для системы: 2CO(г) <=> CO2(г)+С(т), ∆Н < 0
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. («действующая масса» – синоним современного понятия «концентрация»).
Закон действия масс (ЗДМ) выполняется только для элементарных химических реакций, протекающих в одну стадию. Если реакция протекает последовательно через несколько стадий, то суммарная скорость всего процесса определяется самой медленной его частью.
ЗДМ относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

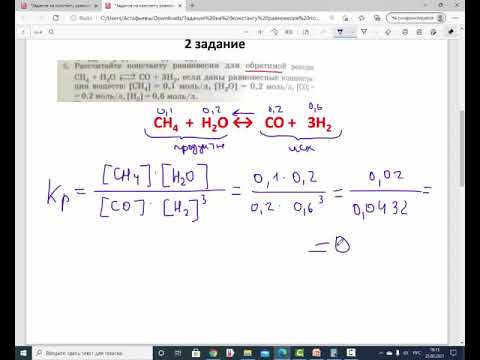
Выражение скорости прямой реакции будет иметь вид: vпр. = kпр.[СО]2.
Выражение скорости обратной реакции будет иметь вид: vобр. = kобр.[СО2].
2. Константа равновесия
Можно выразить константу равновесия через скорость реакции. При этом константа равновесия определяется как
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

K = k1/k-1 = const., где
k1 — константа скорости прямой реакции, k-1 — константа скорости обратной реакции.
Можно выразить Кр через соотношение констант прямо и обратной реакций, получим:
Кр = k-1[СО2]/k1[СО]2 = [СО2]/[СО]2.
Видео:3 1 Константа химической реакцииСкачать

3. Смещение равновесие в системе:
а) При повышении температуры равновесие сместится в сторону обратной реакции, так как прямая реакция – экзотермическая. Согласно принципу Ле-Шателье равновесие реакции смещается в сторону уменьшения оказываемого на систему действия. Данная реакция протекает с выделением тепла (∆Н<0), то, естественно, что при повышении температуры равновесие экзотермической реакции сместится в сторону уменьшения тепловой энергии реакции, т.е. в сторону обратной реакции.
б) При понижении давления смещение равновесия будет наблюдаться в сторону прямой реакции, так как объм газообразного реагента в два раза больше объема продукта реакции системы равну: 2V(СО2) > V(CO).
в) Понижение концентрации продукта реакции (отведение из системы СО2) будет увеличивать скорость прямой реакции, поэтому согласно принципа Ле-Шателье при понижениии концентрации СО2 равновесие сместится в сторону прямой реакции, т. е. в сторону увеличения образования СО2.
Зависимость скорости реакции от концентраций веществ
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Задача 129.
В закрытом сосуде находиться смесь газов, состоящая из 1 моль азота и 3 моль водорода которая реагирует по уравнению:
N2 + 3H2 = 2NH3.
Во сколько раз уменьшится скорость прямой реакции после того как прореагирует 0,65 моль азота.
Решение:
Зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Поэтому изменение концентрации хотя бы одного из реагирующих веществ ведет к изменению ее скорости.
Выражение для скорости реакции до изменения концентрации вещества можно записать в общем виде:
V = k . [N2] . [H2]3
Обозначим скорость реакции до изменения концентраций v1, а после изменения концентраций v2.
Видео:Скорость химических реакций. 9 класс.Скачать

Тогда
v1 = {k [1 . (3)3]};
v2 = {k [0,65 . (3)3]}.
изменение скорости (v1/v2) равно:
Видео:Химическое равновесие. Закон действующих масс.Скачать

v1/v2 = {k [1 . (3)3]}/{k [0,65 . (3)3]} = 1,5.
Ответ: скорость прямой реакции уменьшится в 1,5 раза.
📽️ Видео
Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Интуитивное понимание формулы константы равновесия (не обязательно для продолжения курса)Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Задача химическое равновесие. РАВНОВЕСНЫЕ КОНЦЕНТРАЦИИ и Кр.Скачать

Химическое равновесие. 10 класс.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

83. Химическое равновесиеСкачать

Реакции равновесияСкачать
Урок № 2. Скорость химических реакций. Химическое равновесиеСкачать

Задания на константу равновесия по учебнику ЕреминаСкачать