Расчет температуры кипения и замерзания раствора
Вычисление температуры кипения и замерзания раствора хлорида магния
Задача 394.
Рассчитать температуру кипения и замерзания 5% раствора хлорида магния. Изотонический коэффициент i равен 1,7.
Решение:
М(MgCl2) = 95,211 г/ моль.
5%-ный раствор содержит 5 кг хлорида магния в 95 кг растворителя – воды.
Для рассчета повышения температуры кипения и понижения температуры замерзания растворов используем преобразованные формулы Рауля:
∆tкип. = (iEm1 . 1000)/(m2M);
∆tзам. = (iКm1. 1000)/(m2M).
Здесь
i — изотонический коэффициент, К – криоскопический коэффициент (для воды равен 1,86), Е = эбуллиоскопический коэффициент (для воды равен 0,52 град·кг/моль), m1 и m2 — соответственно масса растворённого вещества (5 кг) и растворителя (95 кг), М — молярная масса растворённого вещества (М(MgCl2) = 95,211 г/ моль).
Тогда
∆tкип. = (iEm1 . 1000)/(m2M) = 1,7 . 0,52 . 5 . 1000)/(95 . 95,211) = ≈ 0,5;
∆tзам. = (iКm1 . 1000)/(m2M) = 1,7 . 1,86 . 5 . 1000)/(95 . 95,211) = 1,75.
Видео:Коллигативные свойства растворовСкачать
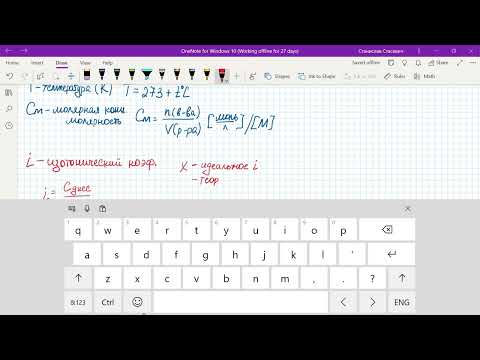
Отсюда
Температуру кипения раствора:
tкип. = 100 + 0,5 = 100,5 °С.
Температуру замерзания раствора:
tзам. = 0 — 1,75 = -1,75 °С.
Ответ: tкип. = 100,5 °С; tзам. = -1,75 °С.
Расчет массы вещества
Задача 395.
Рассчитайте количество (г) нитрата натрия, необходимое для изотонирования 20 см3 раствора серебра нитрата концентрации 0,5%, если изотоническая концентрация натрия хлорида 0,9%, изотонические эквиваленты AgNO3 и NaNO3 по NaCl равны 0,33 и 0,66 соответственно.
Решение:
М(AgNO3) = 169,87 г/моль;
М(NaNO3) = 84,9947 г/моль;
V(p-pa) = 20 см3;
w%(AgNO3) = 0,33;
i(AgNO3) = 0,33;
i(NaNO3) = 0,66;
m(NaNO3) = ?
Рассчитаем массу серебра нитрата в 20 см3 его раствора, получим:
m(AgNO3) = (20 . 0,5)/100 = 0,1 г.
Видео:задачи на коллигативные свойстваСкачать

Расет количества (г) нитрата натрия, необходимое для изотонирования раствора серебра нитрата проведем по формуле:
m2 = {[(0,29 . V)/1000] — [(m1 . i1)/M1)]}/(M2/i2), где
M1 — молекулярная масса основного вещества;
M2— молекулярная масса дополнительного вещества;
m1 — количество основного вещества, в г;
m2 — количество дополнительного вещества, в г;
V — объем прописанного раствора, в мл.
i1 — изотонический эквивалент основного вещества;
i2 — изотонический эквивалент дополнительного вещества;
О,29 — фактор изотонии.
Тогда
m(NaNO3) = {[(0,29 . V(p-pa)/1000] — [m(AgNO3) . i(AgNO3)/М(AgNO3)]}/[М(NaNO3)/i(NaNO3)] =
= [(0,29 . 20)/1000] — [(0,1 . 0,33)/169,87]/(84,9947/0,66) = 0,7 г.
Ответ: 0,7 г.
Задача 396.
Сколько грамм фруктозы надо прибавить к 800 мл воды, чтобы осмотическое давление при температуре 35 °С было равно 178560 Па?
Решение:
М(С6Н12О6) = 180г/моль;
Осмотическое давление определяется по формуле:
Р = СMRT, где
СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура.
Видео:Изменение точки кипения и замерзанияСкачать

Из данного уравнения вытекает, что осмотическое давление растворов зависит от концентрации и температуры.
Тогда
СМ = Р/RT = 178,560кПа/{[8,314 Дж/(моль . К)] . (273 + 35)K} = 0,0697 моль.
Зная осмотическое давление и молярную концентрацию 800 мл раствора фруктозы, рассчитаем массу растворенной фруктозы по формуле:
СМ = [m(B) . 1000]/[M(B) . V(мл)], где
СМ, m(B), M(B) и V(мл) соответственно молярная концентрация, масса, молярная масса растворённого вещества и объём раствора.
Тогда
[m(B) = СМ[M(B) . V(мл)]/1000;
m(С6Н12О6) = (0,0697 . 180 . 800)/1000 = 10 г.
Ответ: m(С6Н12О6) = 10 г.
Расчет концентрации раствора
Видео:3 2 Замерзание и кипение растворовСкачать

Задача 397.
Рассчитайте концентрацию натрия сульфата в моль/л, моль/м3, г/л, % масс в 1 л изотонического раствора, если i = 2,5,
R = 8,314 Дж/(моль . К). Осмотическое давление крови в норме 7,6 атм.
Решение:
М(Na2SO4) = 142,04 г/моль;
Р = 7,6 атм. = 770,07 кПа;
i = 2,5;
R = 8,314 Дж/(моль . К);
Т = 310 К – температура тела человека;
СМ(Na2SO4) = ?
Рассчитаем концентрацию раствора натрия сульфата, используя уравнение:
Р = iCMRT, где
i — изотонический коэффициент; СМ – молярная концентрация электролита (моль/дм3); R – газовая постоянная [8,314 Дж/(моль . К)]; T – температура (К).
Тогда
СM = Р/iRT = 770,07/(2,5 . 8,314 . 310) = 0,1196 моль/дм3 ≈ 0,12 моль/дм3 или 0,12 моль/л.
Рассчитаем массу натрия сульфата в 1 л раствора, получим:
m(Na2SO4) = CМ(Na2SO4) . М(Na2SO4) = 0,12 моль/л . 142,04 г/моль = 16,8 г/л, CМ(Na2SO4) = 16,8 г/л.
Рассчитаем % масс в 1 л изотонического раствора натрия сульфата из пропорции:
Видео:КипениеСкачать

100% — (1000 + 16,8) г
х% — 16,8 г
х% = (16,8 г . 100%)/(1000 + 16,8) = 1,65%.
w%(Na2SO4) = 1,65%.
Ответ: СМ(Na2SO4) = 0,12 моль/дм3 или 0,12 моль/л; 0,12/100 моль/м3; 16,8 г/л; w%(Na2SO4) = 1,65%.
Определение молярной массы вещества
Задача 398.
В 180 г сероуглерода растворили 1,08 г фосфора. Определите молярную массу фосфора в сероуглероде, если температура начала кипения полученного раствора на 0,11 °С выше нормальной температуры кипения CS2. Эбуллиоскопическая константа CS2 равна 2,29 К∙кг/моль.
Решение:
m(CS2) = 180 г;
m(Р) = 1,08 г;
Э(CS2) = 2,29 К∙кг/моль;
∆t = 0,11 °С;
М(Р) = ?
Расчет молярной массы фосфора будем вести по формуле:
М(В) = (1000 . Э . m1)/(m2 . ∆t), где
М(В) — молярная масса вещества;
m1 – масса растворенного вещества;
m2 – масса растворителя;
∆t – величина, показывающая на сколько градусов понизилась температура;
Э – криоскопическая константа.
Тогда
М(Р) = [1000 . Э(CS2) . m(Р)]/[m(CS2) . ∆t] = (1000 . 2,29 . 1,08)/(180 . 0,11) = 124,9 г/моль.
Так как атомная масса фосфора [Ar(P)] ≈ 31 г/моль, то рассчитаем количество атомов в молекуле фосфора, получим:
Видео:Закон РАУЛЯСкачать

N(Р) = М(Р)/Ar(P) = 124,9/31 ≈ 4.
Таким образом, молекула фосфора содержит 4 атома фосфора, значит молярная формула фосфора будет иметь вид: Р4
Ответ: М(Р4) = 124,9 г/моль.
🎬 Видео
Урок 124 (осн). Зависимость температуры кипения жидкости от давленияСкачать

3 6 Осмос Коллигативные свойства растворовСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Определение температуры кристаллизацииСкачать

Задача недели. Химия. №43. Законы РауляСкачать

Коллигативные свойства растворов неэлектролитовСкачать

Физика. 8 класс. Зависимость температуры кипения от внешнего давления /03.11.2020/Скачать

Коллигативные свойства растворовСкачать
Определение температуры замерзания и содержания гликоля в охлаждающих низкозамерзающих жидкостяхСкачать

09 Смеси и растворы 5 коллигативные свойстваСкачать

Лекция 5Скачать

Коллигативные свойства растворов. Законы РауляСкачать

Химия 1.РастворыСкачать

Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать

