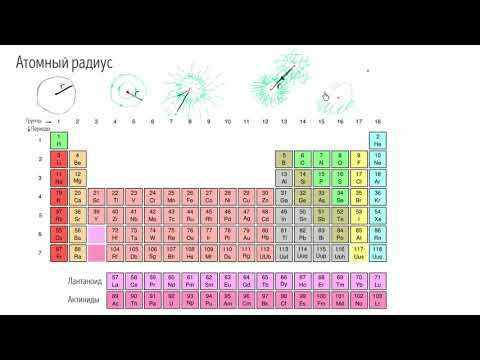
Изменение радиуса атома в пределах периода и в пределах главной и побочной подгрупп
Задача 46.
Понятие радиуса атома. Как происходит изменение радиуса атома в пределах периода и в пределах главной и побочной подгрупп.
Решение:
Радиусы атомов элементов и ионов – условные величины. Их обычно вычисляют из межатомных (межядерных) расстояний, которые зависят не только от природы атомов, но также и от характера химической связи между ними и от агрегатного состояния вещества.
Установлено, что радиусы атомов химических элементов «r» находятся в периодической зависимости от их порядкового номера. В периоде с ростом заряда ядра радиусы атомов уменьшаются, что связано с усилением притяжения внешних электронов к ядру. Наибольшее уменьшение наблюдается у элементов малых периодов. Небольшие размеры атомов элементов второго периода очень сильно влияют на свойства соединений этих атомов, в частности, приводят к устойчивости кратных связей, образованных при дополнительном перекрывании p- орбиталей, ориентированных перпендикулярно (+) межъядерной оси.
В группах элементов по вертикали радиусы атомов увеличиваются. Рост «r» происходит за счет увеличения числа электронных слоев, которые экранируют внешние электроны от ядра. В побочных подгруппах рост «r» имеет место только между первым и вторым элементом (Cr — 1,27; Mo — 1,40; A ), а между вторым и третьим — может быть либо небольшой рост, либо — уменьшение:
Ti = 1,46; Zr = 1,60; Hf =1,59A. Это объясняется тем, что у третьего элемента (W, Hf) происходит дополнительное заполнение внутренней f-подоболочки (без дополнительного изменения числа слоев), что приводит к сжатию электронного облака (f-сжатие), которое компенсирует его расширение за счет увеличения числа слоев.
Таким образом, с возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Энергия ионизации – минимальная энергия, которую необходимо затратить, чтобы удалить валентный электрон из атома, тем самым превратив нейтральный атом в однозарядовый положительный ион (катион).
В периоде с ростом заряда атома энергия ионизации атома возрастает, в подгруппе убывает.
Электроотрицательность (ЭО) – способность атома в соединении притягивать к себе общую электронную пару. Сильнее всего электроны к себе притягивают фтор, кислород и хлор. Этим элементам до завершения внешнего уровня не хватает всего 1-2 электрона. Их электроотрицательность наибольшая.
Легче всего отдают электроны такие элементы как литий, натрий, калий. У них на внешнем уровне всего 1 электрон, и намного проще его отдать, чем притянуть недостающие до завершения уровня. Эти элементы обладают наименьшей электроотрицательностью.
Атомы химических элементов по электроотрицательности располагают в ряд, который начинается наиболее электроотрицательным элементом (фтором) и заканчивает наименее электроотрицательным (калием). Эту шкалу разработал Л. Поллинг.
В периоде электроотрицательность растет с увеличением заряда ядра атома элемента, с уменьшением радиуса атома. В подгруппе электроотрицательность уменьшается. Металлические свойства по периоду слева направо уменьшаются, а неметаллические возрастают. Заканчивается каждый период атомом с устойчивой внешней структурой и поэтому наиболее химически инертным.
Закончить уравнения реакций
Видео:Таблица Менделеева. Металлические и неметаллические свойства. Радиус атома.Скачать

Задача 48.
Написать уравнения всех возможных реакций между оксидом фосфора (V) и
а) оксидом углерода (IV); б) водой; в) гидрооксидом натрия;
г) хлоридом калия; д) гидроксидом бария; е) оксидом кальция
Решение:
а) Фосфор образует высший оксид, формула которого P2O5 по свойствам — это кислотный,солеобразующий оксид. Кислотный оксид не взаимодействует с кислотным оксидом, поэтому P2O5 не реагирует с оксидом углерода (IV) СО2;
б) P2O5 с водой образует ортофосфорную кислоту:
P2O5 + H2O = 2H3PO4;
в) P2O5 с щелочами дает реакцию нейтрализации:
P2O5 + 6NaOH = 2Na3PО4 + 3H O;
г) с хлоридом калия как солью сильной кислоты P2O5 не реагирует;
Видео:Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]Скачать
![Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]](https://i.ytimg.com/vi/N5xnKLO8j4Y/0.jpg)
д) с гидроксидом бария как кислотный оксид P2O5 образует соль и воду:
2P2O5 + 3Ва(ОН)2 = Ва3(PО4)2 + 3H2O;
е) с основными оксидами P2O5 образует соль:
P2O5 + 2K2O = 2K3PO4.
🔍 Видео
Как определить главную и побочную подгруппы в ПСХЭ I ЕГЭ по химииСкачать

Радиус атома, ме и неме свойства, электроотрицательность (закономерности по таблице М.)Скачать

Периодическое изменение свойств атомов химических элементов. 8 класс.Скачать

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Атомный радиус (видео 5) | Периодическая таблица| ХимияСкачать
Химия 8 класс (Урок№28 - Изменение свойств атомов элементов и веществ по периодам и группам.)Скачать

Энергетические уровни. 8 класс.Скачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать

Закономерность изменения свойств элементов в периодах и группах. 10 класс.Скачать

8 класс. Периодическая система. Изменение свойств элементов.Скачать

Фантастические элементы и в каком таблице они обитают | Химия ЕГЭ 2022 | УмскулСкачать

Изменение свойств элементов и их соединений по периодам и группам. Центр онлайн-обучения «Фоксфорд»Скачать

8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Задание 3 на максимум: Как пользоваться таблицей Менделеева на ОГЭ по химии?Скачать

Таблица Менделеева. Задание №3 | Химия ОГЭ 2023 | УмскулСкачать

Периодический Закон | ПСХЭ | Таблица Менделеева [Урок 9]Скачать
![Периодический Закон | ПСХЭ | Таблица Менделеева [Урок 9]](https://i.ytimg.com/vi/oFBqizueCd4/0.jpg)
