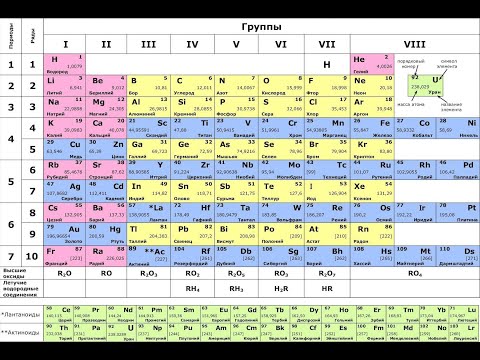
Характеристика элементов III периода периодической системы химических элементов
Характер химической связи в оксидах элементов 3-го периода таблицы Д.И.Менделеева
Задача 35.
Руководствуясь разностью электроотрицательностей, определить, как меняется характер химической связи в оксидах элементов III периода таблицы Д.И.Менделеева.
Решение:
Электроотрицательность («Х») представляет собой обобщенную характеристику элемента, связанную не с электронами на отдельных орбиталях, а с внешними электронами вообще, определяемую как сумма энергии ионизации и сродства к электрону. Под электроотрицательностью понимают относительную характеристику способности атома, притягивать электронную пару. Относительная электроотрицательность в периоде возрастает и уменьшается в подгруппе с ростом заряда ядра.Основные свойства высших оксидов и гидроксидов элементов в периоде закономерно ослабляются, что связано с увеличением силы притяжения гидроксид-ионов к центральному атому с ростом заряда его ядра и уменьшением атомного радиуса, а в подгруппе, в основном, усиливаются, потому что атомный радиус элементов возрастает.
Кислотные свойства этих соединений изменяются в обратном направлении. Неметаллические свойства в периоде, как правило усиливаются слева направо, а в подгруппе – ослабевают сверху вниз, металлические – наоборот.
Если электроотрицательность атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается симметрично по отношению к обоим ядрам.
Если электроотрицательность атомов различная, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае центры (+) и (-) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов (d+ и d-), расстояние между которыми (l) называют длиной диполя.
Подобные ковалентные связи называют полярными. Степень полярности такой связи оценивается значением электрического момента диполя — m, равного произведению эффективного заряда на длину диполя: m = q·l.
Наконец, если разница электроотрицательностей (ΔX) превышает 1,9, то образуется ионная связь – предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов:
(ΔX) Nа2О = 3,44 — 0,93 = 2,51 — связь ионная;
(ΔX) МgО = 3,44 -1,31 = 2,13 — связь ионная;
(ΔX) Аl2О3 = 3,44 – 1,61 = 1,83 — связь ковалентная полярная;
(ΔX) SiО2 = 3,44 — 1,90 = 1,54 — связь ковалентная полярная;
(ΔX) Р2О5 = 3,44 — 2,19 = 1,25 — связь ковалентная полярная;
(ΔX)SОх = 3,44 — 2,58 = 0,86 — связь ковалентная полярная;
(ΔX)СlуОх = 3,44 — 3,16 = 0,28 — связь ковалентная неполярная [(ΔX) < 0,4].
Электронные формулы элементов 3-го периода
Задача 36.
Напишите электронные формулы для элементов III периода, определите их валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s►2s►2р►3s►3р►4s►3d►4р►5s►4d►5р►6s►(5d1)►4f►5d►6р►7s►(6d1-2►5f►6d►7р
Видео:Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать

Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов III периода электронные формулы имеют вид:
а) +11Na 1s2 2s2 2p6 3s1 3p0
Валентные электроны натрия 3s1 находятся на 3s-подуровне На валентной орбитали атома Na находится 1 электрон. Поэтому элемент помещают в первую группу периодической системы Д.И.Менделеева.
б) +12Mg 1s2 2s2 2p6 3s2 3p0
Валентные электроны магния 3s2 находятся на 3s-подуровне На валентной орбитали атома Mg находится 2 электрона. Поэтому элемент помещают во вторую группу периодической системы Д.И.Менделеева.
в) +13Al 1s2 2s2 2p6 3s2 3p1
Видео:Периодический закон и Периодическая система химических элементов | Химия 9 класс #3 | ИнфоурокСкачать

Валентные электроны алюминия 3s2 3p1 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Al находится 3 электрона. Поэтому элемент помещают в третью группу периодической системы Д.И.Менделеева.
г) +14Si 1s2 2s2 2p6 3s2 3p2
Валентные электроны кремния 3s2 3p2 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Si находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева.
д) +15P 1s2 2s2 2p6 3s2 3p3
Валентные электроны фосфора 3s2 3p3 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Р находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
е) +16S 1s2 2s2 2p6 3s2 3p4
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Валентные электроны серы 3s2 3p4 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома S находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева.
ж) +17Cl 1s2 2s2 2p6 3s2 3p5
Валентные электроны хлора 3s2 3p5 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Cl находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева.
з) +18Ar 1s2 2s2 2p6 3s2 3p6.
Валентные электроны аргона 3s2 3p6 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Ar находится 8 электронов. Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева.
🎦 Видео
10 класс § 3 "Периодический закон и Периодическая система химических элементов Д.И. Менделеева"Скачать

Периодическое изменение свойств атомов химических элементов. 8 класс.Скачать

Структура периодической системы химических элементов. 8 класс.Скачать

Периодический Закон | ПСХЭ | Таблица Менделеева [Урок 9]Скачать
![Периодический Закон | ПСХЭ | Таблица Менделеева [Урок 9]](https://i.ytimg.com/vi/oFBqizueCd4/0.jpg)
Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]Скачать
![Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]](https://i.ytimg.com/vi/N5xnKLO8j4Y/0.jpg)
ПЕРИОДЫ в Периодической системе химических элементов элементов Д. И. МенделееваСкачать

Характеристика элемента по положению в Периодической системе и строению атома. 2 часть. 8 класс.Скачать

Характеристика элемента по положению в периодической таблицеСкачать

8 класс. Периодическая система. Изменение свойств элементов.Скачать

Периодический закон | Химия ЦТ, ЕГЭСкачать

Как пользоваться таблицей Менделеева. Химия – простоСкачать

Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

Периодический закон и периодическая система химических элементов Д.И. МенделееваСкачать

Таблица Менделеева. Металлические и неметаллические свойства. Радиус атома.Скачать

6. Периодическая система элементов. Таблица МенделееваСкачать
Периодическая таблица Д.И.Менделеева - лучшая шпаргалка по химии.Скачать

Габриелян О. С. 8 класс §5 "Периодическая система химических элементов Д. И. Менделеева"Скачать

