Характеристика свойств соединений азота
Задача 887.
Какой объем аммиака (условия нормальные) можно получить, подействовав двумя литрами 0,5 н. раствора щелочи на соль аммония?
Решение:
При действии на соли аммония щёлочью получается эквивалентное количество аммиака:
η(щёлочь) = (NH3)
Находим количество щёлочи, пошедшее на реакцию с солью аммония, получим:
1 : 0,5 = 2 : х; х = (0,5 . 2)/1= 1 моль.
1 моль любого газа при нормальных условиях занимает объём равный 22,4 л.
Видео:Кислородсодержащие соединения азота. Видеоурок 31. Химия 9 классСкачать

Отсюда находим, что объём аммиака, выделившегося при реакции, равен:
V(NH3) = VЭ . (NH3) = 22,4 . 1 = 22,4 л.
Ответ: 22,4 л.
Задача 888.
Можно ли в качестве осушителей газообразного аммиака применять Н2SO4 или Р2О5? Ответ мотивировать.
Решение:
Н2SO4 и Р2О5 очень энергично взаимодействуют с водой, серная кислота с образованием кристаллогидратов, а оксид фосфора (V) – с образованием ортофосфорной кислоты Н3РО4:
а) Н2SO4 + Н2О = Н2SO4 . Н2О;
б) Р2О5 +3Н2О = 2Н3РО4.
Поэтому они являются осушителями газовых смесей. В обоих случаях образуются кислоты, с которыми взаимодействует аммиак, образуя соответствующие соли:
2NH3 + Н2SO4 = (NH4)2SO4;
3NH3 + H3PO4 = (NH4)3PO4.
Таким образом, Н2SO4 и Р2О5 нельзя применять в качестве осушителя аммиака, так как при этом происходит химическое взаимодействие аммиака с серной и фосфорной кислотами.
Ответ: Нет, нельзя.
Задача 889.
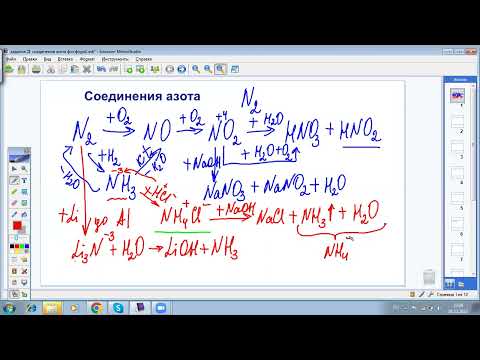
Написать уравнения реакций термического разложения следующих солей: (NH4)2CO3, NH4NO3, (NH4)2SO4, NH4С1, (NH4)2HPO4, (NH4)H2PO4, (NH4)2Cr2O7, NH4NO2.
Решение:
а) (NH4)2CO3 2NH3↑ + CO2↑ + H2O;
б) NH4NO3 N2O↑+ 2H2O
или
2NH4NO3 2N2↑ + O2↑ + 4H2O;
в) (NH4)2SO4 2NH3↑ + H2SO4;
г) NH4С1 NH3↑ + HCl;
д) (NH4)2HPO4 2NH3↑ + H3PO4;
е) (NH4)H2PO4 NH3↑ + H3PO4;
ж) (NH4)2Cr2O7 2NH3↑ + 2CrO3↓ + H2O;
з) NH4NO2 N2↑ + 2H2O.
Задача 890.
Нитрат аммония может разлагаться двумя путями:
NH4NO3(к) N2O(г) + 2H2O(г);
NH4NO3(к) N2(г) + 1/2O2(г) + 2H2O(г).
Какая из приведенных реакций наиболее вероятна и какая более экзотермичная при 25 °С? Ответ подтвердить расчетом ΔG0298 и ΔH0298. Как изменится вероятность протекания этих реакций при повышении температур?
Решение:
а) Уравнение реакции имеет вид:
NH4NO3(к) N2O(г) + 2H2O(г)
Находим ΔH10 реакции, учитывая закон Гесса, получим:
ΔH10 = 2ΔH0(Н2О) + ΔH0(N2O) — ΔH0(NH4NO3) =
= 2(-241,8) + 82,0 – (-365,4) = -36,2кДж.
Видео:Соединения азотаСкачать
Находим энергию Гиббса реакции, получим:
ΔG10 = 2ΔG0(Н2О) + ΔG0(N2O) — ΔG0(NH4NO3) =
= 2(-228,6) + 104,1 – (-183,8) = -169,3 кДж.
б) Уравнение реакции имеет вид:
NH4NO3(к) N2(г) + 1/2O2(г) + 4H2O(г).
Находим реакции, учитывая закон Гесса, получим:
ΔH20 = 2ΔH0(Н2О) + ΔH0(N2) + 1/2ΔH0(О2) — ΔH0(NH4NO3) =
= 2(-241,8) – (-365,4) = -118,2кДж.
Находим энергию Гиббса реакции, получим:
ΔG20 = 2ΔG0(Н2О) + ΔG0(N2O) — ΔG0(NH4NO3) =
= 2(-228,6) – (-183,8) = -273,4 кДж.
ΔH20 < ΔH10 и ΔG20 < ΔG10, поэтому вторая реакция, реакция (б) наиболее вероятна при 25 0С и более зкзотермична, чем реакция (а). Так как обе реакции экзотермичны, то, согласно принципу Ле Шателье, при повышении температуры равновесие обеих реакций сместится влево. Вероятность протекания реакции(б), как наиболее экзотермичной, значительно уменьшится при повышении температуры, чем реакции (а).
📸 Видео
Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Кислородные соединения азотаСкачать

Химия-9. Параграф 18. Кислородные соединения азота.Скачать

Кислородные соединения азотаСкачать

9 класс. Химия. Азот и его соединенияСкачать

§31, 9 кл. Кислородные соединения азотаСкачать

Химия. Кислородные соединения азотаСкачать

Азот и его соединения: химические свойства #азот #химшкола #неметаллы #егэхимияСкачать

Азот - Газ, окружающий нас ПОВСЮДУ!Скачать

Соединения азотаСкачать

9 класс § 31 "Кислородсодержащие соединения азота".Скачать

Соединения азота Аммиак Соли аммонияСкачать

КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТАСкачать

Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

9 класс. Химия. Тема урока: кислородные соединения азота.Скачать
Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

Оксиды азота. Физические свойства. Способы получения | ХимияСкачать

Кислородные соединения азота.Скачать

