Вычисление рН раствора, полученного смещением
Задача 549.
Рассчитать рН раствора, полученного смещением 25 мл 0,5 М раствора НСI, 10 мл 0,5 М раствора NаОН и 15 мл воды. Коэффициенты активности ионов принять равными единице.
Решение:
Рассчитаем количество HCl и NaOH по формуле n = (CM . V)/1000, где V – объём раствора, СМ – концентрация раствора, получим:
n(HCl) = (0,5 . 0,25)/1000 = 0,0125 моль; n(NaOH) = (0,5 . 0,10)/1000 = 0,005 моль.
При смешении растворов кислоты и щёлочи произойдёт реакция нейтрализации:
NaOH + HCl ⇔ NaCl + H2O
Из уравнения реакции следует, что кислота и щёлочь взаимодействуют друг с другом в отношении 1 : 1, значит, в избытке взят раствор кислоты, поэтому в растворе останется некоторое количество HCl, получим:
n’(HCl) = n(HCl) — n(NaOH) = 0,0125 — 0,005 = 0,0075 моль.
Значит, 0,0075 молей HCl содержится в 50 мл раствора, полученного при смешении 25 мл кислоты, 10 мл щёлочи и 15 мл воды. Теперь рассчитаем молярную концентрацию раствора после смешения, получим:
Учитывая, что коэффициент активности равен единице и, что концентрация ионов водорода в растворе одноосновной кислоты равна концентрации её, получим:
[H+] = CM(HCl) = 0,15 моль.
Тогда
pН = lg[Н+] = -lg1,5 . 10-1 = 1 — lg1,5 = 1 — 0,18 = 0,82.
Ответ: 0,82.
Задача 550.
Вычислить рН 0,1 н. раствора уксусной кислоты, содержащего, кроме того, 0,1 моль/л СН3СООNa. Коэффициенты активности ионов считать равными единице.
Решение:
Смесь уксусной кислоты и ацетата натрия представляет собой буферный раствор, рН которого не изменяется при разбавлении водой и при добавлении к нему небольших количеств сильного электролита. Концентрация ионов водорода в буферной системе определяется по формуле:
где
КD – константа диссоциации кислоты, СК – концентрация кислоты, СС — концентрация соли.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Тогда
Теперь определим рН раствора:
pН = lg[Н+] = -lg1,8 . 10-5 = 5 — lg1,8 = 5 — 0,255 = 4,75.
рН буферного раствора можно определить по формуле:
где pKD = -lgKD.
Отсюда
Ответ: 4,75.
Задача 551.
Как изменится рН, если вдвое разбавить водой: а) 0,2 М раствор НСI; б) 0,2 М раствор СН3СООН; в) раствор, содержащий 0,1 моль/л СН3СООН и 0,1 моль/л?
Решение:
а) HCl – сильный электролит, поэтому его степень диссоциации равна единице. Тогда концентрацию ионов водорода найдем по формуле [H+] = CM ., получим:
[H+] = 0,2 . 1 = 0,2 моль.
Отсюда
pН1 = lg[Н+] = -lg2 . 10-1 = 1 — lg2 = 1 — 0,30 = 0,70.
При разбавлении раствора в двое, соответственно в два раза уменьшится концентрация раствора, тогда [H+] = 0,2/2=0,1моль/л.
Отсюда
pН’1 = lg[Н+] = -lg1 . 10-1 = 1 — lg1 = 1 — 0,0 = 1,0.
Находим изменение рН раствора:
pН’1 — pН1 = 1 — 0,70 = 0,30.
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Таким образом, увеличение рН раствора составило 0,3.
б) Уксусная кислота как слабый электролит диссоциирует по схеме:
Рассчитаем концентрацию ионов водорода в растворе кислоты по формуле [Н+] = CM . получим:
[Н+] = 0,2 . 9,5 . 10-3 = 1,9 . 10-3.
Отсюда
pН2 = lg[Н+] = -lg1,9 . 10-3 = 3 — lg1,9 = 3 — 0,29 = 2,71.
При разбавлении раствора в двое, соответственно в два раза уменьшится концентрация раствора, тогда
[Н+]’2 = 0,2/2=0,1 моль/л.
Определим степень диссоциации кислоты по формуле:
Тогда
pН’2 = lg[Н+] = -lg1.34 . 10-3 = 3 — lg1,9 = 3 — 0,13 = 2,87.
Находим изменение рН раствора:
pН’2 — pН2 = 2,87 — 1,71 = 0,16.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Таким образом рН раствора уксусной кислоты увеличилась на 0,16.
в) Смесь уксусной кислоты и ацетата натрия представляет собой буферный раствор, рН которого не изменяется при разбавлении водой и при добавлении к нему небольших количеств сильного электролита. Концентрация ионов водорода в буферной системе определяется по формуле:
где
КD – константа диссоциации кислоты, СК – концентрация кислоты, СС — концентрация соли.
Тогда
При разбавлении буферной смеси отношение концентраций кислоты и соли не изменится, поэтому рН смеси тоже не изменится и будет равно:
pН = lg[Н+] = -lg1,8 . 10-5 = 5 — lg1,8 = 5 — 0,255 = 4,75.
Ответ: а) увеличится на 0,3; б) увеличилась на 0,16; в) не изменится.
📹 Видео
Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Вычисление рН в растворах солейСкачать

Особые случаи pH растворов. Решение задач на рН.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать
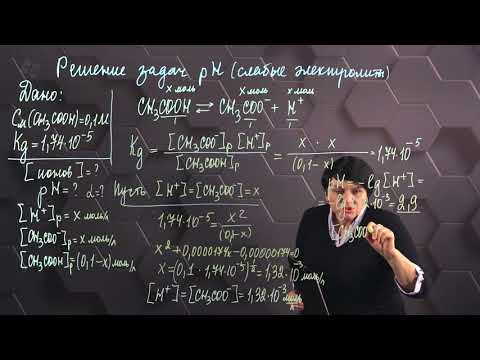
Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

pH растворов | Основные понятия | Олимпиадные задачи по химииСкачать

Расчет рН растворов сильных и слабых оснований. Химия для поступающих.Скачать

Решение задачи на pH | Химия ЦТ, ЦЭ, ЕГЭ | Решение задач по химии | Химия для школьниковСкачать

Определение рН потенциометрическим методомСкачать

Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])Скачать
![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)
pH раствора солиСкачать

Тема 17. Понятие о водородном показателе (рН) раствораСкачать

Задачи на примеси. 1 часть. 9 класс.Скачать

pH и буферные растворы | Медицинская химия | МедвузаСкачать

Потенциометрический принцип измерения рНСкачать

Вывод формулы для расчета pH буферного раствораСкачать

Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])Скачать
![Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])](https://i.ytimg.com/vi/0qTq4bM0zHk/0.jpg)
