Как правильно определять простейшую и истинную формулу вещества
Вывод формулф дисилана
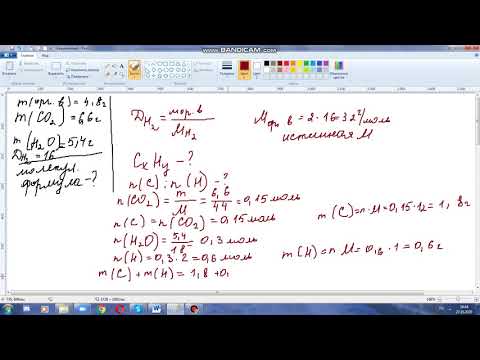
Задача 66.
При сжигании 6,2 г соединения получено 12 г оксида кремния (IV) и 5,4 г воды. Плотность паров соединения по гелию равна 15,5. Выведите молекулярную формулу соединения.
Решение:
Учитывая то, что при сжигании некоторого соединения получено оксид кремния и вода, можно предположить, что это кремневодород (SixHy).
Дано:
Ar(Si) = 28 г/моль;
D(He) = 15,5;
М(SiО2) = 60 г/моль;
М(Н2О) = 18,01528 г/моль;
М(He) = 4 г/моль;
m(SiO2) = 12 г;
m(H2O) = 5,4 г;
SiхНу = ?
1. Молекулярная формула SiхНу.
М(SхНу) = M(He) • D(He) = 4 • 15,5 = 62 г/моль.
2. Уравнение реакции:
SiхНу + О2 = SiО2 + Н2О
3. Определим количество кремния:
n(SiO2) = n(Si);
n(Si) = m(SiО2)/М(SiО2) = 12/60 = 0,2 моль.
4. Определим количество водорода:
Используем следующий алгоритм: m(Н2О) = n(Н2О) = 2n(Н)
п(Н) = 2m(Н2О)/М(Н2О) = (2 • 5,4)/18,01528 = 0,6 моль.
Запишем соотношение количеств веществ в искомом углеводороде:
Видео:Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

п(Si): n(Н) = 0,2: 0,6.
5. Определяем простейшую формулу SixНy.
х(Si) : у(Н) = 0,2 : 0,6
Выбираем наименьшее значение (в данном случае 0,2) и делим на него оба числа:
х(Si) : н(Н) = (0,2/0,2) : (0,6/0,2) = 1:3
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: Si1H3.
6. Выявление истинной формулы.
Вещества с формулой SiН3 не существует. В истинной формуле сгоревшего углеводорода индексы будут в некоторое число раз больше, чем в простейшей.
Определим значение молярной массы для простейшей формулы:
М(прост.) = (1 • 28) + (3 • 1) = 31 г/моль.
Истинная молярная масса сгоревшего вещества больше молярной массы простейшей формулы, следовательно, индексы в простейшей формуле необходимо увеличивать.
Рассчитаем индекс, т.е. во сколько раз молярная масса вещества больше молярной массы простейшей формулы:
М(SiхНу)/М(прост.) = 62/31 = 2.
Умножаем индексы в простейшей формуле на «2» и получаем истинную формулу:
Si2Н6 [М(прост.) • 2 = 31 • 2 = 62 г/моль].
Si2Н6 соответствует общей формуле силана SinH(2n + 2), где n = 2. Эта формула соответствует дисилану.
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Ответ: Si2Н6 — дисилан.
Вывод формулы октана
Задача 67.
Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества.
Решение:
D(Возд.) = 3,93;
w%(C) = 84,21%;
w%(Н) = 15,79;
М(Возд.) = 29 г/моль;
Обозначим числа атомов углерода и водорода в простейшей формуле вещества соответственно через x и y. Молекулярная формула вещества будет иметь вид: СхHy. Молекулярная масса углеводорода:
М(СхHy) = D(Возд.) . М(Возд.) = 3,93 . 29 = 113,97 или 114 г/моль. Атомные массы этих элементов равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе вещества относятся как 12х : 1у. По условию задачи это отношение имеет вид: 12 : 1. Следовательно:
12х : 1у = 84,21 : 15,79.
Откуда
х : y = (84,21/12) : (15,79/1) = 7,01 : 15,79.
Чтобы выразить полученное отношение целыми числами, разделим все два его члена на наименьший из них, т.е. на 7,01, получим:
х : y = 7,01/7,01) : (15,79/7,01) = 1 : 2,252496 или 1 : 2,25.
Приведем оба члена к целым числам, множив их на минимальное число индекса 4, получим:
х : y = 4 : 9.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С4Н9.
Находим молярную массу углеводорода состава С4Н9, получим:
М(С4Н9) = (4 . 12) + (9 . 1) = 57 г/моль.
Сравним истинную и расчетные молярные массы, и рассчитаем индекс n для углерода и водородв в молекуле С4Н9:
n = М(СхHy)/М(С4Н9) = [114 г/моль]/57 г/моль = 2.
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Тогда истинная формула углеводорода будет иметь вид:
n(C4H9) = 2(C4H9) = C8H18
Вещество с формулой С8Н18 реально существует. Так как молярные массы совпадают (М(СхНу) = М(С8Н18).
Вещество с формулой С8Н18 называется октан.
Ответ: С8Н18.
Вывод формулы щавелевой кислоты
Задача 68.
В состав вещества входит водород, углерод, кислород, соответственн 2,2%, 26,6% 71,2% молекулярная масса этого вещества = 90, найдите истинную формулу вещества, назовите это вещество и напишите его краткую структурную формулу.
Решение:
М(СхНyOz) = 90 г/моль;
w%(C) = 26,6%;
w%(Н) = 2,2;
w%(О) = 71,2%;
СхНyOz = ?
Обозначим числа атомов углерода, водорода и кислорода в простейшей формуле вещества соответственно через x, y и z.
Атомные массы этих элементов равны соответственно 12, 1 и 16. Поэтому массы углерода, водорода и кислорода в составе вещества относятся как 12х : 1у : 16z. По условию задачи это отношение имеет вид: 26,6% : 2,2% : 71,2%. Следовательно:
12х : 1у : 16z = 26,6 : 2,2 : 71,2.
Откуда
х : y : z = (26,6/12) : (2,2/1) : (71,2/16) = 2,2 : 2,2 : 4,45.
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них, т.е. на 2,2, получим:
х : y : z = (2,2/2,2) : (2,2/2,2) : (4,45/2,2) = 1 : 1 : 2 или 1 : 1 : 2.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С1Н1O2.
Находим молярную массу вещества состава С1Н1O2, получим:
М(С1Н1O2) = (1 . 12) + (1 . 1) + (2 . 16) = 45 г/моль.
Сравним истинную и расчетную молярные массы, рассчитаем индекс n для вещества С1Н1O2:
Видео:Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать

n = М(СхHyOz)/М(С1Н1O2) = [90 г/моль]/45 г/моль = 2.
Тогда истинная формула вещества будет иметь вид:
n(СхHyOz) = 2(С1Н1O2) = C2H2О4.
Вещество с формулой C2H2О4 реально существует. Так как молярные массы совпадают (М(СхHyOz) = М(C2H2О4).
Веществу с формулой C2H2О4 соответствует щавелевая кислота.
Краткая структурная формула щавелевой кислоты:
НООС — СООН
Ответ: C2H2О4.
Вывод формулы этана
Задача 69.
При горении углеводорода, плотность паров которого по аргону равна 0,75, образовалось 44,8 л (н. у.) углекислого газа и 54 г воды. Укажите название углеводорода.
Решение:
М(Ar) = 40 г/моль;
М(H2O) = 18 г/моль;
Vm = 22,4 л/моль;
V(СО2) = 44,8 л;
m(H2O) = 54 г;
D(Ar) = 0,75;
CxHy = ?
Рассчитаем истинную молярную массу вещества CxHy, получим:
М(CxHy) = D(Fr) . М(Ar) = 0,75 . 40 = 30 г/моль.
Обозначим числа атомов углерода и водорода в простейшей формуле углеводорода соответственно через x и y.
Так как при горении углеводородов всегда образуется углекислый газ и вода, то отношения их количеств имеют вид:
n(CO2) : n(H2O) = (44,8/22,4) : (54/18) = 2 . 3.
Учитывая, что в молекуле СО2 содержится 1 атом углерода, а в молекуле Н2О = 2 атома водорода, то соотношение С : 2Н = х : 2у = 2 : (2 . 3) = 2 : 6. Это дает возможность записать простейшую формулу: С2Н6.
Находим молярную массу вещества состава С2Н6, получим:
М(С2Н6) = (2 . 12) + (1 . 6) = 30 г/моль.
Сравним истинную и расчетную молярные массы, получим:
Видео:Поиск формулы вещества по продуктам его сгоранияСкачать

М(CxHy) = М(С2Н6) = 30 г/моль.
Вещество с формулой С2Н6 реально существует и называется этан.
Вывод формулы пропана
Задача 70.
Определите молекулярную формулу углеводорода с массовой долей углерода в нем 81,8%. Относительная плотность данного вещества по азоту равна 1,57.
Решение:
М(С) = 12 г/моль;
М(Н) = 1 г/моль;
М(N2) = 28 г/моль;
w%(C) = 81,8%;
D(N2) = 1,57;
CxHy = ?
Рассчитаем молярную массу исходного вещества, получим:
CxHy = D(N2) . М(N2) = 1,57 . 28 = 44 г/моль.
Рассчитаем массовую долю водорода, получим:
w%(H) = 1 — w%(C) = 1 — 81,8 = 18,2%.
Обозначим числа атомов углерода и водорода в простейшей формуле вещества соответственно через x и y. Молекулярная формула вещества будет иметь вид: СхHy. Атомные массы этих элементов равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе вещества относятся как 12х : 1у. По условию задачи это отношение имеет вид: 12 : 1. Следовательно:
12х : 1у = 81,8 : 18,2.
Откуда
х : y = (81,8/12) : (18,2/1) = 6,82 : 18,2.
Выбираем наименьшее значение (в данном случае 6,82) и делим на него оба числа:
х : y = (6,82/6,82) : (18,2/6,82) = 1 : 2,6686.
Приведем оба члена к целым числам, множив их на возможное минимальное число индекса 3, получим:
Видео:Решение простых задач на вывод формулСкачать

х : y = (1 . 3) : (2,6686 . 3) = 3 : 8.0058 ≈ 3 : 8.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С3Н8.
Находим молярную массу углеводорода состава С3Н8, получим:
М(С3Н8) = (3 . 12) + (8 . 1) = 44 г/моль.
Истинная и расчетная молярные массы совпадают М(СхНу) = М(С3Н8) = 44 г/моль. Значит, формула вещества С3Н8, это формула пропана.
Ответ: С3Н8, пропан (CH3—CH2—CH3).
🎬 Видео
10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Поиск формулы вещества по массовым долям элементовСкачать

вывод формулы орг вещества по продуктам сгорания задача1Скачать
Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Задачи на вывод формул веществаСкачать

Задачи по химии. Органические вещества. Вывод формулСкачать

вывод формулы органического веществаСкачать

Решение задач на вывод формул органических веществСкачать

Определение формулы органических соединений. 1 часть. Практическая часть - решение задачи. 9 класс.Скачать

Задачи по химии. Алканы. Вывод формулСкачать

ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ. ХИМИЯ ЕГЭСкачать

ЕГЭ. Химия. #Урок15. Задачи на вывод формулы по продуктам сгоранияСкачать

20. Выведение формулы вещества (задачи)Скачать

