Решение задач по химии на расчет температуры кипения и моляльной концентрации раствора
Задача 499.
В 200 г воды растворено: 1) 31 г карбамида СО(NH2)2; 2) 90 г глюкозы C6H12O6. Будет ли температура кипения этих растворов одинакова: а) да; б) нет?
Решение:
M(СО(NH2)2) = 60 г/моль, M(C6H12O6) = 180 г/моль. Для расчетов температур кипения растворов неэлектролитов используем уравнение:
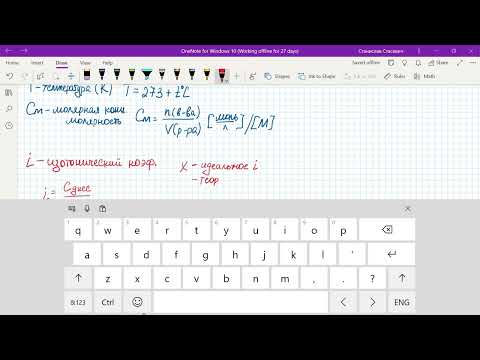
где СМ— моляльная концентрация m1 — масса растворённого вещества; m2 — масса растворителя; М – молярная масса растворённого вещества; Е – эбуллиоскопическая константа (для воды Е = 0,52); tкип — повышение температуры кипения.
Находим повышение температуры кипения растворов мочевины и глюкозы:
(tкип)[СО(NH2)2] = (0,52 . 31 . 1000)/((200 . 60) = 1,34;
(tкип)(C6H12O6) = (0,52 . 31 . 1000)/((200 . 180) = 0,45.
Так как для обоих растворов повышение температуры кипения растворов (tкип) различно, то температура кипения этих растворов неодинакова.
Ответ: б) нет.
Задача 500.
В 250 г органического растворителя содержатся (g) г растворенного неэлектролита с молекулярной массой (М). Криоскопическая постоянная растворителя равна К. Какое выражение для tкрист правильно: а) Kg/M; б) 4Kg/M; в) Kg/4M.
Решение:
Понижение температуры кристаллизации раствора определяется по уравнению:
tкрист = СМ . К
где СМ— моляльная концентрация m1 — масса растворённого вещества; m2 — масса растворителя; М – молярная масса растворённого вещества; К — криоскопическая константа. Подставив в уравнение данные задачи, получим выражение для tкрист:
Видео:задачи на коллигативные свойстваСкачать

Ответ: б).
Задача 501.
Некоторый водный раствор неэлектролита кипит при 373,52 К. Какова моляльная концентрация этого раствора: а) СМ = 1; б) СМ = 0,1; в) СМ = 0,01 моль на 1000 г Н2О?
Решение:
Из уравнения:
tкип = tкип(Н2О) + tкип
где
tкип (Н2О) = 373К (273+100=373), рассчитаем повышение температуры кипения раствора:
tкип = tкип — tкип (Н2О) = 373,52 = 373 = 0,52
Из уравнения:
tкип = СМ . Е,
где
CМ — моляльная концентрация Е – эбуллиоскопическая константа (для воды Е = 0,52), находим моляльную концентрацию, получим:
Ответ: а).
Задача 502.
Нужно приготовить раствор, содержащий в 1 л 0,5 моля NaCl, 0,16 моля KCl и 0,24 моля K2SO4. Как это сделать, имея в своем распоряжении только NaCl, KCl и Na2SO4?
Решение:
Найдём общее количество ионов в полученном растворе:
0,5М NaCl: n(Na+) = 0,5 моля, n(Cl—) = 0,5 моля;
0,16М KCl: n(K+) = 0,16 моля, n(Cl—) = 0,16 моля;
0,24М K2SO4: n(K+) = 0,48 моля (2 . 0,24 = 0,48), n(SO42-) = 0,24 моля.
Таким образом, в полученном растворе содержится следующее количество ионов:
n(SO42-) = 0,24 моля, n(K+ = 0,64 моля, n(Cl—) = 0,66 моля и n(Na+) = 0,5 моля.
Необходимое количество ионов (SO42-) можно получить из 0,24 молей Na2SO4, что даст 0,48 молей ионов Na+. Недостающее количество ионов Na+ можно взять из 0,02 молей NaCl (0,50 – 0,048 = 0,02), что даст 0,02 моля ионов (K+). Тогда недостающее количество ионов Cl— можно взять, если прибавить 0,64 моля KCl (0,66 – 0,02 = 0,64), что даст 0,64 моля ионов (K+), необходимое количество для полученного раствора.
Таким образом, необходимо взять 0.24 моля Na2SO4, 0,02 моля NaCl и 0,64 моля KCl.
Ответ: 0.24 моля Na2SO4, 0,02 моля NaCl и 0,64 моля KCl.
📸 Видео
8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Коллигативные свойства растворовСкачать
Изменение точки кипения и замерзанияСкачать

3 6 Осмос Коллигативные свойства растворовСкачать

Закон РАУЛЯСкачать

ЗАДАЧИ НА РАСТВОРИМОСТЬ ЗА 5 МИНУТ?😳|AllesСкачать

Кипение, удельная теплота парообразования. 8 класс.Скачать

3 2 Замерзание и кипение растворовСкачать

Решение задач на теории растворов. 11 класс.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Молярная концентрация. 10 класс.Скачать

MB2 . Как решать задачи на приготовление растворовСкачать

Алгоритм: Убираем переедание и тягу к сладкомуСкачать

Решение задач по теме "Растворы" | Химия, онлайн-форумСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Решение задач на теории растворов. 11 класс.Скачать

Коллигативные свойства растворов неэлектролитовСкачать

Плавление и кристаллизация твердых тел, температура плавления, удельная теплота плавления. 8 класс.Скачать

