Заполнение электронных орбиталей атомов элементов | Правила Клечковского
Задача 175.
Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l = 2? l = 3?
Решение:
Атомные орбитали, которым отвечает значение орбитального квантового числа l, равное 2, называются d-орбиталями. На d-орбитали (d-подуровне) находится пять АО. Графическая схема d-подуровня имеет вид:
mi — магнитное квантовое число определяет направление электронного облака в пространстве, и принимает значения 0 и целых чисел -1, -2, -3, +1, +2, +3. Так как на d-подуровне содержится пять АО, то, соответственно будет иметь пять разных целочисленных значений, а именно: -2, -1, 0, +1, +2.
Для электронов энергетического подуровня, орбитальное квантовое число которого l = 3, соответствует f-подуровень, содержащий семь АО: . Следовательно, электронам, расположенным на f-подуровне, соответствуют семь значений: -3, -2, -1, 0, +1, +2, +3.
Ответ: 5; 7.
Задача 176.
Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n = 4?
Решение:
В электронном слое с главным квантовым числом n = 4 содержится четыре энергетических подуровня: s-, p-, d- и f-подуровни. Графически это можно представить в виде схемы:
Из схемы вытекает, что в электронном слое с главным квантовым числом n = 4 содержится 16 АО: одна s, три — p, пять — d и семь f. В каждой АО может содержаться по два электрона с противоположными спинами. Таким образом, на четвёртом энергетическом уровне может содержаться 32 электрона (2 . 16 = 32).
Для математического расчёта максимального количества содержания электронов в слое существует простая формула N = 2n2 ,где n — главное квантовое число.
Тогда максимальное число электронов в четвёртом слое равно:
N = 2 . 42 = 32
Ответ: 32.
Задача 177.
Определить по правилу Клечковского последовательность заполнение электронных орбиталей, характеризующихся суммой n + l: а) 5; б) 6; в) 7.
Решение:
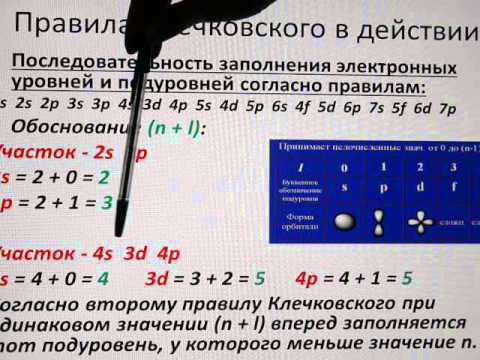
Согласно правилам Клечковского, АО заполняются электронами в порядке последовательного увеличения суммы n + l (первое правило Клечковского), и при одинаковых значениях этой суммы – в порядке последовательного возрастания главного квантового числа (2-е правило Клечковского).
а) По условию задачи сумма n + l = 5, причём из всех возможных комбинаций n + l, соответствующих этой сумме (n = 3, l = 2; n = 4, l = 1; n = 5, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. 3d, затем – 4p, а после 4p – 5s.
Таким образом, при сумме n + l =5 порядок заполнения орбиталей будет следующий: 3d?4p?5s..
б) При сумме n + l = 6 из всех возможных комбинаций n + l, соответствующих этой сумме (n + 4, l = 2; n = 5, l = 1; n = 6, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т. е. 4d, затем – 5p, а после 5p – 6s.
Таким образом, при сумме n + l = 6 порядок заполнения орбиталей будет следующий: 4d?5p?6s.
в) При сумме n + l = 7 возможны комбинации n + l, соответствующих этой сумме (n + 4, l = 3; n = 5, l = 2; n = 6, l = 1; n = 7, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. 4f, затем – 5d, далее 6p и уже потом только — 7s.
Таким образом, при сумме n + l = 7 порядок заполнения орбиталей будет следующий: 4f?5d?6p?7s.
Ответ: а) 3d→4p→5s; б) 4d→5p→6s; в) 4f→5d→6p→7s.
Задача 178.
Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4р.
Решение:
а) 4d-подуровень начинает заполняться после 5s-подуровня. 5s-подуровень начинает заполняться после заполнения электронами 4p-подуровня, т.е. после заполнения оболочки криптона – элемента №36.
Согласно правилу Клечковского после криптона будет заполняться 5s-подуровень, после него – 4d-подуровень. На 5s-подуровне, состоящем из одной атомной орбитали, может находиться два электрона, а на 4d-подуровне, состоящем из пяти атомных орбиталей, может находиться десять электронов. Значит, порядковый номер элемента, с полностью заполненным 4d-подуровнем должен быть на двенадцать больше, чем у криптона (№ 36), значит, элемент № 48 (кадмий). Но, учитывая «провалы» электронов у рутения, родия и палладия с 5s-подуровня на 4d-подуровень (у рутения и родия по одному электрону, а у палладия – два), то 4d-подуровень полностью заполняется электронами у палладия (элемент № 46). Но у элемента № 47 окончательно заканчивается заполнение 4d-орбитали, и 47-й электрон занимает 5s-орбиталь. Таким образом, элемент с порядковым номером 47 считается элементом, у которого заканчивается заполнение электронами 4d-орбитали. Отсюда вывод – порядковый номер элемента 47 (серебро Ag).
б) Согласно правилу Клечковского заполнение электронами 4p-подуровня начинается после заполнения всех атомных орбиталей 3d-подуровня. Элементом, у которого заканчивается заполнение электронами 3d-подуровня является элемент № 30 (цинк). Значит, элементом, у которого начнётся заполнение электронами 4p-подуровня, будет элемент № 31 (галлий Ga).
Ответ: а) Ag; б) Ga.
Задача 179.
Какой подуровень заполняется в атомах после подуровня 5s?
Решение:
Подуровню 5s соответствует сумма n + l, равная 5 (5 + 0 = 5). Такой же суммой n +l характеризуется 4p-подуровень, но заполнению этого подуровня предшествует заполнению 5s-подуровня, так как последнему отвечает большее значение главного квантового числа (второе правило Клечковского). Следовательно, после заполнения 5s-подуровня будет заполняться подуровень с суммой n + l = 6, причём из всех возможных комбинаций n + l, соответствующих этой сумме (n + 4, l = 2; n = 5, l = 1; n = 6, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. вслед за 5s-подуровнем будет заполняться 4d-подуровень n + l = 6.
Ответ: 4d.
Задача 180.
У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого подуровня?
Решение:
Согласно правилам Клечковского 4f-подуровень (n = 4, l = 3) с суммой n + l, равной 7, и с наименьшим значением главного квантового числа, должен заполняться после заполнения 6s-подуровня с суммой n + l, равной 6. Электронную конфигурацию последнего энергетического уровня 6s2 имеет атом элемента № 55 (барий). Затем, у элемента № 57 (лантан), должен начать заполняться 4f-подуровень, но, на самом деле у лантана, расположенного непосредственно после бария появляется не 4f-, а 5d-электрон. Однако уже у следующего за лантаном церия (Z = 58) действительно начинается застройка 4f-подуровня, на который переходит и единственный 5d-электрон, имевшийся в атоме лантана, в соответствии с этим электронная структура атома церия выражается формулой [Kr]4f26s2. Начиная с церия, происходит последовательное заполнение всех орбиталей 4f-подуровня. Далее, начатое заполнение 4f-подуровня у атома церия заканчивается у иттербия (Z = 70).
Ответ: Ce; Yb.
Задача 181.
Какой подуровень заполняется в атомах после заполнения подуровня 5р? После заполнения подуровня 5d?
Решение:
а) Подуровню 5p соответствует сумма n + l = 6 (5 + 1 = 6). Такой же суммой n + l характеризуются подуровни 4d и 6s. Заполнение 4d-подуровня, согласно 2-му правилу Клечковского, предшествует заполнению подуровня 5p. После заполнения электронами подуровня 5p, согласно 2-му правилу Клечковского, начнёт заполняться 6s-подуровень, которому отвечает большее значение главного квантового числа n (n = 6).
б) Подуровню 5d соответствует сумма n + l = 7 (5 + 2 = 7). Такой же суммой n + l характеризуется подуровень 4f, но заполнение этого подуровня предшествует заполнению подуровня 5d, так как последнему отвечает большее значение главного квантового числа. Следовательно, согласно 1-го правила Клечковского, будет заполняться подуровень, которому отвечает на единицу большее значение n + l (n = 6) при сумме n + l = 7. Этому условию отвечает подуровень 6p (n = 6, l = 1) при сумме n + l = 7.
Ответ: 6s; 6p.
Задача 182.
Записать электронные формулы атомов элементов с зарядом ядра: а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n — главное квантовое число, l — орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – (s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (1-е правило Клечковского), а при одинаковых значениях суммы n + l — в порядке последовательного возрастания главного квантового числа (2-е правило Клечковского). Последовательность заполнения энергетических уровней следующая:
1s →2s → 2p → 3s → 3p→4s → 3d → 4p → 5s → 4d → 5p→ 6s →
→ (5d1) → 4f → 5d → 6p→7s → (6d1-2) → 5f → 6d →7p.
Так как число электронов в атоме элемента численно равно его порядковому номеру в таблице Д.И. Менделеева, то электронные формулы элементов №№ 8, 13, 18, 23, 53, 63, 83 будут иметь вид:
а) +8О 1s22s22p4;
б) +13Al 1s22s22p63s23p1;
в) +18Ar 1s22s22p63s23p6;
г) +23V 1s22s22p63s23p63d34s2;
д) +53I 1s22s22p63s23p63d104s24p64d105s25p5;
е) +63Eu 1s22s22p63s23p63d104s24p64d104f75s25p66s2;
ж) +83Bi 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p3.
Графические схемы заполнения валентных орбиталей атомов элементов:
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника , кружочка или линейки , а электроны в этих ячейках обозначают стрелками . В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например
Мы будем применять линейки. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
📽️ Видео
100. Правила КлечковскогоСкачать

Урок 182 (осн). Вихревые токи. Задачи на правило ЛенцаСкачать

Квантовые числа. Принцип Паули, правило Гунда (Хунда) и правило Клечковского. 2 часть. 10 класс.Скачать

Урок 181 (осн). Электромагнитная индукцияСкачать

Урок 177 (осн). Действие магнитного поля на проводник с токомСкачать

Электронные формулы атомов (теория). Правила Клечковского, Хунда, принцип ПаулиСкачать
Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Следственные действия УПК | Что нужно знать?Скачать

В ЕГО РОСТ СЛОЖНО ПОВЕРИТЬ! #shortsСкачать

Как перестать бить в сетку // Атака после высокой передачи в волейболе // Совет недели #1Скачать

Тест скорости чтенияСкачать

Как проверяют учеников перед ЕНТСкачать

Урок 281. Электромагнитная индукция. Магнитный поток. Правило ЛенцаСкачать

Задачи на монотонность функцииСкачать

Деление трёхзначного числа на двухзначное число 1Скачать

Урок 176 (осн). Телеграфный аппаратСкачать

В помощь школьнику : правила заполнения атомных орбиталейСкачать
А у тебя идеальный вес?Скачать

Урок 180 (осн). Задачи на магнитные явленияСкачать

