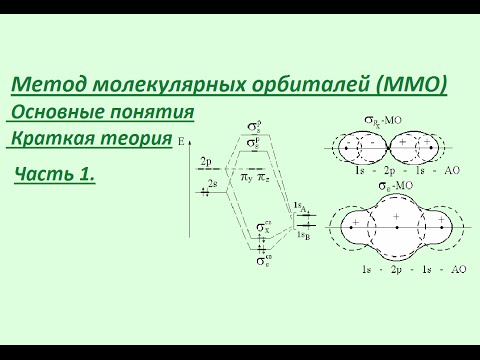
Составление энергетических схем молекул, ионов, используя метод атомнных орбиталей
Видео:Метод молекулярных орбиталей. Часть 1. Основные понятия.Скачать
Энергетические схемы образования молекул берилия и неона
Задача 243.
Почему не могут существовать устойчивые молекулы Ве2 и Ne2?
Решение:
Энергетические схемы образования молекул а) Be2, б) Ne2:
В молекуле Ве2 на МО два электрона занимают связывающую, а два – разрыхляющую орбитали. В молекуле Ne2 на МО шесть электронов занимают связывающие, а шесть разрыхляющие орбитали. Как видно из энергетических схем Ве2 и Ne2 в обеих молекулах разность между числом связывающих и числом разрыхляющих электронов равна нулю, что отвечает кратности связей 0. Следовательно, образование молекул Ве2 и Ne2 не будет сопровождаться выделением энергии. Действительно, молекулы Ве2 и Ne2 не существуют.
Видео:Метод молекулярных орбиталей. Часть 2. Построение энергетических схем.Скачать

Энергетические схемы образования частиц — О22-, О2—, О2, О2+
Задача 244.
Как изменяются длина связи, энергия диссоциации и магнитные свойства в ряду: О22- ⇔ О2— ⇔ О2 ⇔ О2+. Ответ мотивировать.
Решение:
Энергетические схемы образования частиц О22- ⇔ О2— ⇔ О2 ⇔ О2+:
Как видно из энергетических схем в частицах О22- ⇔ О2— ⇔ О2 ⇔ О2+ разность между числом связывающих и числом разрыхляющих электронов равна соответственно 2, 3, 4 и 5, что отвечает кратности связи соответственно 1; 1,5; 2 и 2,5. Следовательно, длина связи в ряду: О22- ⇔ О2— ⇔ О2 ⇔ О2+ закономерно уменьшается, а энергия диссоциации с уменьшением (упрочнением) связи увеличивается. Частица О22- не имеет неспаренных электронов на связывающих и разрыхляющих орбиталях, вследствие чего она может быть диамагнитная. В частицах О2—, О2 и О2+ имеются неспаренные электроны на связывающих и разрыхляющих орбиталях соответственно 1, 2 и 1; вследствие чего они могут быть парамагнитные.
Энергетические схемы образования частиц — NO+, NO или NO—
Задача 245.
Какая из частиц — NO+, NO или NO— характеризуется наименьшей длиной связи?
Решение:
Энергетические схемы образования частиц NO+, NO или NO—:
Как видно из энергетических схем в частицах NO+, NO, NO— разность между числом связывающих и числом разрыхляющих электронов равна соответственно 6, 5 и 4, что отвечает кратности связи соответственно 3; 2,5 и 2. Следовательно, частица NO характеризуется наименьшей длиной связи, кратность связи наименьшая (2).
🌟 Видео
Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Урок 243. Подготовка к КР по электростатике - 1Скачать

Химия 11 класс (Урок№3 - Пространственное строение молекул.)Скачать

Урок 245. Подготовка к КР по электростатике - 3Скачать

Разбор схемы гальванического элементаСкачать

Химия 8 класс (Урок№27 - Расположение электронов по энергетическим уровням.)Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

Метод молекулярных орбиталей (химическая связь, часть 3)Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Урок 242. Задачи на электроемкостьСкачать

Вывод закона сохранения механической энергии | Физика 9 класс #22 | ИнфоурокСкачать

Урок 241. Энергия электрического поляСкачать

Метод молекулярных орбиталей. Часть 3. Расчет порядка (кратности) связи.Скачать

Леменовский Д. А. - Неорганическая химия I - Метод молекулярных орбиталейСкачать

Гибридизация. Полярные и неполярные молекулы. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Разбираем ВСЕ задачи первой части: задания 23, 26, 27, 28 | Алгоритмы решенияСкачать

