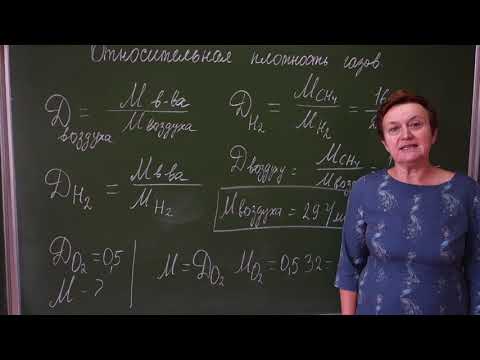- Расчеты содержания элементов в веществе по его формулам (в граммах, молях и массовых долях).
Пример 11. Из образца горной породы массой 25 г, содержащего минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(образца) = 25 г
m(Ag) = 5,4 г
Решение 1. Для решения используем формулы: n =; m = n· M;
w(X) =.
2. Находим химическое количество выделенного серебра:
n(Ag) == = 0,05 моль
3. Находим химическое количество аргентита:
n(Ag2S) : n(Ag) = 1 : 2
n(Ag2S) = n(Ag) = · 0,05 моль = 0,025 моль.
4. Определяем массу аргентита в образце горной породы:
Mr(Ag2S) = 2Ar(Ag)+Ar(S) = 2·108 + 32 =248; M(Ag2S)= 248 г/моль
m(Ag2S) = n(Ag2S) · M(Ag2S) = 0,025 моль · 248 г/моль = 6,2 г.
5. Находим массовую долю аргентита в образце горной породы:
w(Ag2S) = = = 0,248 (24,8%);
Ответ: массовая доля аргентита в образце горной породы составляет 24,8%.
Найти w(Ag2S)
- Установление эмпирической и молекулярной (истинной) формул по массовым долям элементов, входящих в состав вещества.
Пример 12. Установите молекулярную формулу вещества, если массовая доля углерода в нем составляет 26,67%, водорода – 2,22%, кислорода – 71,11%. Относительная молекулярная масса этого вещества равна 90.
Дано: CxHyOz
w(C) = 0,2667 (26,67%)
w(H) = 0,0222 (2,22%)
w(O) = 0,7111 (71,11%)
Mr(CxHyOz) = 90
Решение 1. Для решения задачи используем формулы: w =;
n =; x : y : z = n(C) : n(H) : n(O).
2. Находим химические количества элементов, входящих в состав вещества, приняв, что m(CxHyOz) = 100 г.
m(C) = w(C) · m(CxHyOz) = 0,2667 · 100 г = 26,67 г.
m(H) = w(H) · m(CxHyOz) = 0,0222 · 100 г = 2,22 г.
m(O) = w(O) · m(CxHyOz) = 0,7111 · 100 г = 71,11 г.
Видео:Расчетные задачи | Химия 10 класс | УмскулСкачать
n(C) = = = 2,22 моль.
n(H) = = = 2,22 моль.
n(O) = = = 4,44 моль.
3. Определяем эмпирическую формулу вещества:
n(C) : n(H) : n(O) = 2,22 моль : 2,22 моль : 4,44 моль.
x : y : z = 1 : 1 : 2.
Эмпирическая формула вещества – CHO2.
4. Устанавливаем истинную молекулярную формулу вещества:
Mr(CHO2) = Ar(C) + Ar(H) + 2Ar(O) = 12 + 1 + 2·16 = 45;
Mr(CHO2) : Mr(CxHyOz) = 45 : 90 = 1 : 2.
Истинная молекулярная формула вещества – C2H2O4.
Ответ: молекулярная формула вещества C2H2O4.
Найти x, y, z
- Вычисление по уравнению химической реакции объемов газов по известному химическому количеству одного из веществ.
Пример 13. Какой объем водорода (н.у.) выделится при реакции цинка химическим количеством 0,5 моля с избытком раствора соляной кислоты?
Дано: n(Zn) = 0,5 моль
Решение 1. Составляем уравнение реакции цинка с раствором соляной кислоты:
0,5 моля 0,5 моля
Zn + 2HCl = ZnCl2 + H2
1 моль 1 моль
2. Для решения используем формулу: V = n · Vm.
3. По уравнению реакции находим химическое количество выделившегося водорода: n(H2) = n(Zn) = 0,5 моль.
4. Определяем объем выделившегося водорода:
V(H2) = n(H2) · Vm = 0,5 моль · 22,4 дм3/моль = 11,2 дм3.
Ответ: выделится водород объемом 11,2 дм3.
Найти V(H2)
- Расчет объемных отношений газообразных веществ по химическим уравнениям.
Пример 14. Какой объем оксида углерода(IV) образуется при сгорании ацетилена объемом 5 дм3(н.у.)?
Дано: V(C2H2) = 5 дм3
Решение 1. Составляем уравнение реакции горения ацетилена:
5 дм3 X дм3
2C2H2 + 5O2 = 4CO2 + 2H2O
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать
2V 4V
2. Для решения, согласно закону объемных отношений газов при химических реакциях, используем формулу: V(C2H2) : V(CO2) = 2 : 4;
V(C2H2) : V(CO2) = 1 : 2.
3. Определяем объем выделившегося водорода:
V(CO2) = 2V(C2H2) = 2· 5 дм3 = 10 дм3.
Ответ: образуется оксид углерода(IV) объемом 10 дм3.
- Вычисление относительной плотности и молярной массы газов.
Пример 15. Вычислите молярную массу газа, относительная плотность которого по водороду равна 32. Рассчитайте относительную плотность этого газа по воздуху.
Дано: (газа) = 32
M(возд.) » 29 г/моль
Решение 1. Для решения используем формулу: (x) = .
2. Вычисляем молярную массу газа:
M(газа) = (газа) · M(H2) = 32 · 2 г/моль = 64 г/моль.
3. Определяем относительную плотность газа по воздуху:
(газа) = = = 2,207.
Ответ: молярная масса газа – 64 г/моль, относительная плотность этого газа по воздуху – 2,207.
Найти M(газа)
(газа)
- Вычисление молярной концентрации газов.
Пример 16. В сосуд объемом 5 дм3 поместили газообразные вещества: A (химическим количеством 2 моль) и B (химическим количеством 3 моль). Вычислите молярные концентрации этих веществ в смеси.
Дано: V = 5 дм3
n(A) = 2 моль
n(B) = 3 моль
Решение 1. Для решения используем формулу: c(X) = .
2. Вычисляем молярные концентрации газов:
c(A) = = = 0,4 моль/дм3.
c(B) = = = 0,6 моль/дм3.
Ответ: молярная концентрация вещества A – 0,4 моль/дм3, а молярная концентрация вещества B – 0,6 моль/дм3.
Найти c(A), c(B)
- Расчеты по термохимическим уравнениям.
Пример 17. При сжигании серы массой 1 г выделилось количество теплоты 9,28 кДж. Составьте термохимическое уравнение реакции.
Дано: m(S) = 1 г
Q’ = 9,28 кДж
Решение 1. Составляем уравнение термохимическое реакции горения серы:
0,0313 моль +9,28 кДж
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать
S + O2 = SO2 ± Q
1 моль
2. Для решения задачи используем формулу: n =.
3. Находим химическое количество серы:
n(S) == = 0,0313 моль.
3. Находим тепловой эффект реакции горения серы и составляем термохимическое уравнение:
Q = = 296,5 кДж.
S + O2 = SO2 + 296,5 кДж
Ответ: S + O2 = SO2 + 296,5 кДж
Найти Q - Вычисления по уравнениям реакций, протекающих в растворах.
Пример 18. Какая масса раствора соляной кислоты с массовой долей HCl 20% потребуется для нейтрализации раствора гидроксида натрия массой 45 г с массовой долей NaOH 15%?
Дано: w(HCl) = 0,2 (20%)
w(NaOH) = 0,15 (15%)
mр—ра(NaOH) = 45 г
Решение 1. Составляем уравнение реакции нейтрализации:
0,169 моль 0,169 моль
NaOH + HCl = NaCl + H2O
1 моль 1 моль
2. Для решения используем формулы: w(в-ва) = ;
n =.
3. Вычисляем массу и химическое количество NaOH:
m(NaOH) = mр-ра(NaOH) · w(NaOH) = 45 г · 0,15 = 6,75 г
Mr(NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40;
M(NaOH) = 40 г/моль;
n(NaOH) = == 0,169 моль.
4. Определяем по уравнению реакции химическое количество HCl:
n(HCl) = n(NaOH) = 0,169 моль.
5. Вычисляем массу чистого вещества и массу раствора HCl:
Mr(HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5;
Видео:Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать
M(HCl) = 36,5 г/моль;
m(HCl) = n(HCl) · M(HCl) = 0,169 моль · 36,5 г/моль = 6,2 г
mр-ра(HCl) = = = 31 г
Ответ: потребуется раствор соляной кислоты массой 31 г.
Найти mр-ра(HCl)
- Расчет массы (объема вещества), необходимого для приготовления раствора с заданной массовой долей (молярной концентраций).
Пример 19. Какой объем раствора серной кислоты плотностью 1,8 г/см3 с массовой долей H2SO4 88% нужно взять для приготовления раствора кислоты объемом 300 см3 и плотностью 1,3 г/см3 с массовой долей H2SO4 40%?
Дано: w1(H2SO4) = 0,88 (88%)
ρ1(р-ра) = 1,8 г/см3
w2(H2SO4) = 0,4 (40%)
ρ2(р-ра) = 1,3 г/см3
V2(р-ра) = 300 см3
Решение 1. Для решения задачи используем формулы:
w(в-ва) = ; V = .
2. Определяем массу полученного раствора и массу H2SO4 в нем:
m2(р-ра) = ρ2(р-ра) · V2(р-ра) = 1,3 г/см3 · 300 см3 = 390 г.
m2(H2SO4) = m2(р-ра) · w2(H2SO4) = 390 г · 0,4 = 156 г.
3. Находим массу и объем исходного раствора:
m1(H2SO4) = m2(H2SO4) = 156 г.
m1(р-ра) = = = 177,3 г.
V1(р-ра) = = = 98,5 см3.
Ответ: потребуется раствор кислоты объемом 98,5 см3.
Найти V1(р-ра)
Пример 20. Какой объем раствора серной кислоты плотностью 1,035 г/см3 с массовой долей H2SO4 5,5% нужно взять для приготовления раствора серной кислоты объемом 300 см3 с молярной концентрацией H2SO4 0,25 моль/дм3?
Дано: w1(H2SO4) = 5,5 (0,055%)
ρ1(р-ра) = 1,035 г/см3
с2(H2SO4) = 0,25 моль/дм3
V2(р-ра) = 300 см3
Решение 1. Для решения задачи используем формулы:
c(X) = ; w(в-ва) = ; m = n· M; V = .
2. Находим химическое количество H2SO4 в полученном растворе:
n2(H2SO4) = c2(H2SO4) · V2(р-ра) = 0,25 моль/дм3 · 0,3 дм3 =
= 0,075 моль.
Видео:10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать
3. Находим массу H2SO4 в исходном растворе:
n1(H2SO4) = n2(H2SO4) = 0,075 моль.
Mr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2·1 + 32 + 4·16 = 98
M(H2SO4) = 98 г/моль.
m2(H2SO4)= n2(H2SO4)· M(H2SO4)= 0,075 моль · 98 г/моль =
= 7,35 г.
4. Находим массу и объем исходного раствора:
m1(р-ра) = = = 133,6 г.
V1(р-ра) = = = 129,1 см3.
Ответ: потребуется раствор кислоты объемом 129,1 см3.
Найти V1(р-ра)
- Определение практического выхода продукта реакции.
Пример 21. При пропускании сероводорода объемом 2,8 дм3 (при н.у.) через избыток раствора сульфата меди(II) образовался осадок массой 11,4 г. Вычислите выход продукта реакции.
Дано: V(H2S) = 2,8 дм3
m практ.(CuS) = 11,4 г
Решение 1. Составляем уравнение реакции нейтрализации:
0,125 моль 0,125 моль
CuSO4 + H2S = CuS↓ + H2SO4
1 моль 1 моль
2. Для решения задачи используем формулы:
η = ; n =.
3. Находим химическое количество сероводорода:
n(H2S) == = 0,125 моль.
4. Определяем химические количества сульфида меди(II)
(теоретически возможное и практически полученное):
nтеор.(CuS) = n(H2S) = 0,125 моль.
Mr(CuS) = Ar(Cu) + Ar(S) = 64 + 32 = 96
M(CuS) = 96 г/моль.
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать
nпракт.(CuS) = == 0,119 моль.
5. Вычислите выход продукта реакции.
η(CuS) = = = 0,952 (95,2%)
Ответ: выход продукта реакции составляет 95,2%.
Найти V1(р-ра)
💡 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать

Задачи на ИЗБЫТОК и НЕДОСТАТОК | Самое простое объяснениеСкачать

Задачи на "избыток" и "недостаток". 1 часть. 10 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

ВСЕ ТИПЫ ЗАДАЧ на ОГЭ по химии | УмскулСкачать

Олимпиадная Химия. Расчетные олимпиадные задачиСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

День 4. Все типы расчетных задач 26, 27, 28 | Интенсив ХИМФАК mini | ЕГЭ по химии 2022Скачать

Как решать ЗАДАЧИ по ХИМИИ? Химия с нуляСкачать