1861 г. Томас Грэм ввел термин коллоиды (κόλλα — клей).
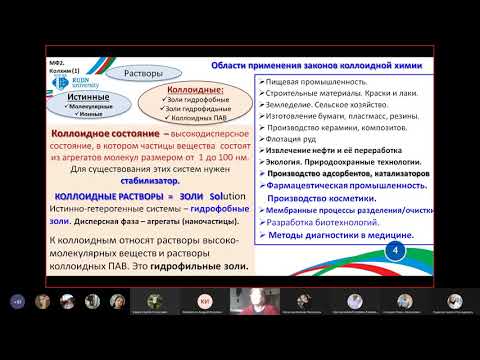
Коллоидная химия — наука, изучающая вещества, находящиеся в дисперсном состоянии и поверхностные явления в дисперсных системах.
Диспергирование — тонкое измельчение твердого тела или жидкости, в результате которого образуются порошки, суспензии, эмульсии.
Дисперсная система — гетерогенная двух- или многофазная система, в которой одно вещество, находящееся в диспергированном состоянии (дисперсная фаза) распределено в среде другого (дисперсионная среда).
Видео:Коллоидные растворы. Дисперсные системыСкачать

Степень измельчения можно характеризовать следующими параметрами:
- линейным размером частиц r;
- дисперсностью D;
- удельной поверхностью S_1.
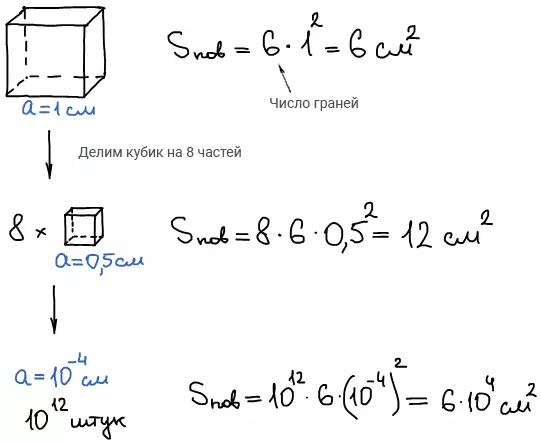
Дисперсность — физическая величина, которая показывает какое число частиц можно уложить вплотную в одном кубическом метре. Чем меньше размер частиц, тем больше дисперсность. Определяют как отношение суммарной поверхности раздела фаз к объему этих частиц.
Удельная поверхность — это отношение суммарной поверхности к общей массе частиц.
Влияние диспергирования на свойства системы: высокая развитая поверхность.
Видео:ФИЗИЧЕСКАЯ ХИМИЯ (ТЕРМОДИНАМИКА). ОСНОВНЫЕ ПОНЯТИЯ: СИСТЕМЫ, ПАРАМЕТРЫ, ФУНКЦИИСкачать

Такая большая поверхность придает дисперсным системам особые свойства.
Классификация дисперсных систем
По размерам частиц дисперсной фазы
| Размер частиц, м | Система, см | |
|---|---|---|
| 10^{-10} | 10^{-8} | Молекулярный раствор |
| 10^{-9}–10^{-8} | 10^{-7}–10^{-6} | Ультра-микро-дисперсная |
| 10^{-8}–10^{-6} | 10^{-6}–10^{-4} | микрогетерогенная (высокодисперсная) |
| >10^{-6} | >10^{-4} | Грубой дисперсии |
Различия между истинным раствором, коллоидной системой и грубой дисперсией:
| Истинный раствор | Коллоидная система | Грубая дисперсия | |
|---|---|---|---|
| Видимость в оптическом микроскопе | Нет | Нет | Видны |
| Проходимость через бумажный фильтр | Да | Да | Нет |
| Через полупроницаемую перегородку | Да | Нет | Нет |
| Самопроизвольное образование | Да, ΔG<0 | Нет, ΔG>0 | Нет, ΔG>0 |
| Термодинамическая устойчивость | Да | Да/нет | Нет |
| Гомогенность | Да | Нет | Нет |
По агрегатным состояниям дисперсной среды и дисперсной фазы
| № | Д.С. | Д.Ф. | Условное обозначение | Примеры: |
|---|---|---|---|---|
| 1 | Тв | Тв | Т/Т | Минералы, сплавы, горные породы |
| 2 | Тв | Ж | Ж/Т | Почва, грунт, ткани жив. орг. |
| 3 | Тв | Г | Г/Т | Пористые тела, катализаторы в газах |
| 4 | Ж | Тв | Т/Ж | Суспензии, пасты, пульпы, золи |
| 5 | Ж | Ж | Ж/Ж | Эмульсии |
| 6 | Ж | Г | Г/Ж | Пены |
| 7 | Г | Тв | Т/Г | Пыль, порошки, дым |
| 8 | Г | Ж | Ж/Г | Облака, туман |
| 9 | Г | Г | — | — |
По характеру межмолекулярных взаимодействий между дисперсной средой и дисперсной фазы
Эта классификация пригодна только для систем с жидкой дисперсионной средой:
- Лиофильные — термодинамические устойчивые. Например, мыло в воде.
- Лиофобные — не устойчивы, слабые межмолекулярные взаимодействия. Например, нафталин в воде.
Первоначально Зигмонди предложил классифицировать коллоидные растворы по способности сухого остатка, полученного в результате осторожного выпаривания жидкости, растворяться в чистой дисперсионной среде.
- Необратимые коллоидные системы — системы, сухой остаток которых не способен самопроизвольно диспергироваться в дисперсионной среде. Например: лиозоли металлов, гидрозоли иодида серебра.
- Обратимые коллоидные системы — системы, сухой остаток которых при соприкосновении со средой обычно сначала набухает, а затем самопроизвольно растворяется и снова образует коллоидную систему. Например, раствор желатина в воде, раствор каучука в бензоле.
Фрейндлих высказал мнение, что обратимость и необратимость коллоидной системы определяется взаимодействием дисперсной фазы с дисперсной средой:
- В случае обратимых коллоидов есть взаимодействие между дисперсионной средой и фазой. Такие растворы называются лиофильными коллоидными растворами (если ДС — вода, то гидрофильными).
- В случае необратимых — взаимодействия нет, следовательно ДФ не способна растворяться в ней. Такие системы Фрейндлих назвал лиофобными (гидрофобными, если ДС — вода).
🔍 Видео
Химия | Дисперсные системыСкачать

Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать

СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Коллоидная химия. Лекция 1. Физико-химия поверхностных явленийСкачать

Видеоурок по химии "Дисперсные системы"Скачать

Вводная видеолекция к курсу "Физическая и коллоидная химия"Скачать

Поверхностное натяжение (видео 3) | Силы межмолекулярного взаимодействия | ХимияСкачать
Ерёмин В. В. - Общая химия - Основные понятия химии (Лекция 1)Скачать

ЭТО НУЖНО ЗНАТЬ — Химия с нуля, Основные Химические ПонятияСкачать

Матвеенко В. Н. - Коллоидная химия - Коллоидная химия как наука. Предмет изученияСкачать

Суспензии, коллоиды и растворыСкачать
Н.К.Иванова. ЗНТШ21: Коллоидная химия.Скачать

Коллоидная химия. Лекция 2. Физико - химия дисперсных системСкачать

10 класс § 10 "Коллоидные растворы"Скачать

Коллоидная химия. Мицеллы | Лекция 3Скачать