Определение простейшей и истинной формулы углеводорода
Видео:Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать

Вывод истинной формулы амина
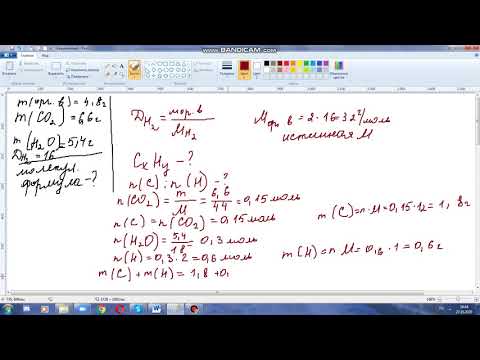
Задача 87.
При сжигании неизвестного амина в кислороде было получено 1,344 л углекислого газа (н.у.), 1,35 г воды и 0,112 л азота (н.у.). Определите молекулярную формулу неизвестного вещества, если известно, что в одной молекуле амина содержится один атом азота. При изучении строения неизвестного вещества стало ясно, что оно содержит первичных атомов углерода в два раза больше вторичных атомов углерода, а третичных атомов углерода не содержит вовсе. Определите структурную формулу этого амина. Напишите реакцию его взаимодействия с азотистой кислотой.
Решение:
Рассчитаем количества углерода, водорода и азота в сожженом амине, получим:
n(CO2) = n(C) = V(CO2)/Vm = 1,344/22,4 = 0,06 моль;
n(Н2О) = n(Н2) = 2n(Н) = 2[m(Н2О)/M(Н2О)] = 2(1,35/18) = 0,15 моль;
n(N2) = n(N) = 2[V(N2)/Vm] = 2(0,112/22,4) = 0,01 моль.
Определим простейшую формулу вещества, обозначив числа атомов углерода, водорода и азота в простейшей формуле вещества соответственно через x, y и z.
Количества этих элементов равны соответственно 0,06 моль, 0,15 моль и 0,01 моль. Поэтому количества углерода, водорода и азота в составе вещества относятся как:
х : у : z = 0,06 : 0,15 : 0,01.
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них, т.е. на 0,01, получим:
х : y : z = (0,06/0,01) : (0,15/0,01) : (0,01/0,01) = 6 : 15 : 1.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу вещества: С6Н15N1 или С6Н15N.
По условию задачи известно, что оно содержит первичных атомов углерода в два раза больше вторичных атомов углерода, а третичных атомов углерода не содержит вовсе. Предположительно, эта общая формула принадлежит дипропиламину — вторичный амин. Структурная формула дипропиламина имеет вид:
СН3-СН2-СН2-NH-CH2-CH2-CH3.
Реакция взаимодействия дипропиламина с азотистой кислотой:
СН3-СН2-СН2-NH-CH2-CH2-CH3 + HNO2 = СН3-СН2-СН2-N-CH2-CH2-CH3 + H2O.
|
N=O
N-нитрозодипропиламин: СН3-СН2-СН2-N(NO)-CH2-CH2-CH3.
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Вывод истинной формулы галогеноводорода
Задача 88.
Навеску галогенопроизводного углеводорода массой 1,9125 г сожгли в избытке кислорода. Продукты реакции пропустили сначала через избыток раствора нитрата серебра (при этом выпало 3,5875 г осадка), а затем через избыток известковой воды (при этом образовалось 7,5 г осадка). Установите молекулярную формулу органического вещества, если плотность его паров по воздуху равна 2,638. Известно, что данное вещество можно получить из соответствующего алкена. Составьте уравнение реакции, укажите условия её протекания.
Решение:
1. Рассчитаем массу хлора в навеске (Сl)
Уравнение реакции имеет вид:
HCl + AgNO3 = HNO3 + AgCl↓.
Из уравнения реакции следует что из 1 моль HCl образуется 1 моль AgCl, т.е. n(НCl) = n(AgCl).
Тогда
n(НCl) = n(AgCl) = m(AgCl)/M(AgCl) = 3,5875/143,3212 = 0,02503 моль.
Так как n(Cl) = n(НCl), то n(Cl) = 0,02503 моль.
Отсюда
m(Cl) = n(Cl) . М(Cl) = 0,02503 . 35,461 = 0,88742 г.
2. Рассчитаем массу углерода в навеске (С)
Уравнение реакции имеет вид:
Сa(OH)2 + CO2 = CaCO3↓ + H2O
Из уравнения реакции следует, что из 1 моль СО2 образуется 1 моль СаСО3, т.е. n(СО2) = n(СаСО3).
Тогда
n(СО2) = n(СаСО3) = m(СаСО3)/M(СаСО3) = 7,5/100 = 0,075 моль.
Так как n(С) = n(СО2), то n(C) = 0,075 моль.
Отсюда
m(C) = n(C) . М(C) = 0,075 . 12 = 0,9 г.
3. Рассчитаем массу водорода в навеске (Н), получим:
m(H) = m(навески) — m(Cl) — m(C) = 1,9125 — 0,88742 — 0,9 = 0,12508 г.
4. Рассчитаем массовые доли углерода, водорода и хлора в навескеБ получим:
w%(C) = m(C)/m(навески) = 0,9/1,9125 = 0,4706 или 47,06%;
w%(Н) = m(H)/m(навески) = 0,12508/1,9125 = 0,0654 или 6,54%;
w%(Cl) = m(Cl)/m(навески) = 0,88742/1,9125 = 0,4640 или 46,40%.
5. Определим простейшую формулу вещества
Обозначим числа атомов углерода, водорода и хлора в простейшей формуле вещества соответственно через x, y и z.
Атомные массы этих элементов равны соответственно 12, 1 и 35,461. Поэтому массы углерода, водорода и хлора в составе вещества относятся как 12х : 1у : 35,461z. С учетом массовых долей этих элементов это отношение будет иметь вид: 47,06% : 6,54% : 46,40%. Следовательно:
12х : 1у : 35,461z = 47,06%% : 6,54% : 46,40%.
Откуда
х : y : z = (47,06/12) : (6,54/1) : (46,40/35,461) = 3,92 : 6,54 : 1,31.
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них, т.е. на 6,54, получим:
х : y : z = (3,92/6,54) : (6,54/6,54) : (1,31/6,54) = 0,6 : 1 : 0,2.
Еще раз для выражения отношения целыми числами, разделим все три его члена на наименьший из них, т.е. на 0,2, получим:
х : y : z = (0,6/0,2) : (1/0,2) : (0,2/0,2) = 3 : 5 : 1.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу вещества: С3Н5l1.
6. Рассчитаем значения молярных масс для простейшей формулы и исследуемого вещества
M(C3H5Cl1) = (12 . 3) + (1 . 5) + 35,461 = 76,46 ≈ 76,5 г/моль;
M(CxHyClz) = D(возд.) . М(возд.) = 2,638 . 29 ≈ 76,5 г/моль.
Истинная молярная масса сгоревшего вещества и молярная масса простейшей формулы совпадают, следовательно формула сгоревшего вещества имеет вид: C3H5Cl.
C3H5Cl соответствует формуле хлорциклопропана, который получают из циклопропена.
Определение истинной формулы алкена
Задача 89.
В результате пропускания алкена массой 33,6 г через избыток разбавленного раствора перманганата калия выпал осадок массой 54 г. Установите молекулярную формулу алкена.
Решение:
Общая формула алкенов CnH2n;
m(MnO2) = 54 г;
M(MnO2) = 86,9368 г/моль;
m(CnH2n) = 33,6 г.
Алкены окисляются водным раствором перманганата калия по общему уравнению:
ЗСnН2n + 2KМnO4 + 4Н2O = 3CnH2n(OH)2 + 2MnO2↓ + 2KOH.
Получается, что из 3 моль алкена массой 3.(12n + 2n) = 42n образуется 2 моль МnО2 (2 . 87 = 174 г).
Тогда
42n = 174
Откуда
n = 174/42 = 4. Значит, истинная формула алкена будет иметь вид: С4Н8.
Формула С4Н8 соответствует бутену.
Ответ: С4Н8.
Вывод молекулярной формулы исходного органического соединения при его сжигании
Задача 90.
При сгорании органического вещества массой 46,2 г выделилось 158,4 г углекислого газа и 27 г воды. Относительная плотность вещества по воздуху равна 5,31. Определите формулу и напишите реакцию горения этого вещества.
Решение:
Обозначим
Рассчитаем молярную массу органического вещества, получим:
СхНy = D(возд.) . М(возд.) = 5,31 . 29 = 154 г/моль.
Рассчитаем значение «х», получим
n(СО2) = n(С) = m(СО2)/M(СО2) = 158,4/44 = 3,6 моль;
m(С) = 3,6 моль . 12 = 43,2 г;
w%(C) = 43,2/46,2 = 0,935;
х = [М(CxHy) . w%(C)]/M(C) = (0,935 . 154)/12 = 12.
Рассчитаем значение «у», получим:
n(Н2О) = 1/2n(Н) = m(Н2О)/M(Н2О) = 27/18 = 1,5 моль;
n(Н) = 2n(Н2О) = (2 . 1,5 = 3 моль;
m(Н) = n(Н) . M(Н) = (3 . 1) = 3 г;
w%(H) = 3/46,2 = 0,0649;
y = [М(CxHy) . w%(H)]/M(H) = (0,0649 . 154)/1 = 10.
Это дает возможность записать простейшую формулу вещества: С12Н10.
Рассчитаем значение молярной массы для простейшей формулы:
M(С12Н10) = (12 . 12) + (10 . 1) = 154 г/моль.
Истинная молярная масса сгоревшего вещества и молярная масса простейшей формулы совпадают, следовательно формула сгоревшего вещества имеет вид: С12Н10.
С12Н10 соответствует формуле дифенила.
Реакцию горения этого вещества имеет вид:
2C12H10 + 29O2 = 24CO2 + 10H2O.
Определение эмпирической и молекулярной формулы кислоты
Задача 91.
Анализ органической кислоты, выделенной из продуктов жизнедеятельности растительного организма, показывает, что она содержит 40% углерода, 6,7% водорода и 53,3% кислорода. Относительная плотность по водороду равна 30,015. Определите эмпирическую и молекулярную формулу для этой кислоты.
Решение:
Запишем общую формулу органической кислоты, обозначив за «х» атом углерода, за «y» атом водорода, а за «z» — атом кислорода получим:
СxНyOz.
Атомные массы элементов углерода, водорода и кислорода равны соответственно 12 г/моль, 1 г/моль и 16 г/моль. Поэтому массы углерода, водорода и кислорода в составе вещества относятся как 12х : 1y : 16z. С учетом массовых долей этих элементов это отношение будет иметь вид: 40% : 6,7% : 53,3%. Следовательно:
12х : 1y : 16z = 40% : 6,7% : 53,3%.
Откуда
х : y :z = (40/12) : (6,7/1) : (53,3/16) = 3,33 : 6,7 : 3,33.
Еще раз для выражения отношения целыми числами, разделим все три его члена на наименьший из них, т.е. на 3,33, получим:
х : y :z = (3,33/3,33) : (6,7/3,33) : (3,33/3,33) = 1 : 2 : 1.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу вещества:
СxНyOz = С1Н2О1.
Рассчитаем молярные массы для простейшей формулы и исследуемого вещества, получим:
M(С1Н2О1) = (1 . 12) + (2 . 1) + (1 . 16) = 30 г/моль;
M(СxНyOz) = D(Н2) . М(Н2) = 30,015 . 2 ≈ 60 г/моль.
Истинная молярная масса органической кислоты и молярная масса простейшей формулы ее не совпадают, значит органическая кислота с формулой С1Н2О1 не существует.
Рассчитаем индекс, т.е. во сколько раз молярная масса вещества больше молярной массы простейшей формулы:
М(СxНyOz)/М(С1Н2О1) = 60/30 = 2.
Умножаем индексы в простейшей формуле на «2» и получаем истинную формулу: С2Н4О2.
Тогда
М(С2Н4О2) = 60 г/моль.
Эта формула соответствует уксусной кислоте, ее структурная формула имеет вид: СН3СООН.
Ответ: СН3СООН — уксусная кислота.
🎦 Видео
Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Поиск формулы вещества по продуктам его сгоранияСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Решение задачи по химии на установление формулы органического вещества | Химия ЦТ, ЕГЭСкачать

вывод формулы органического веществаСкачать

10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать

ЕГЭ. Химия. #Урок15. Задачи на вывод формулы по продуктам сгоранияСкачать

Поиск формулы вещества по массовым долям элементовСкачать

Решение задач на определение молекулярной формулы органического вещества -три типаСкачать

ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ. ХИМИЯ ЕГЭСкачать

Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

Рудзитис Фельдман задача 11 стр 87 10 класс химия решениеСкачать

Задачи по органике. Вывод формулы вещества на основании общей формулы гомологического ряда.Скачать

Определение формулы органического веществаСкачать

вывод формулы орг вещества по продуктам сгорания задача1Скачать
Решение задач на нахождение молекулярной формулы вещества по известной относительной плотности газаСкачать

Решение задач: Вывод формулы веществаСкачать

