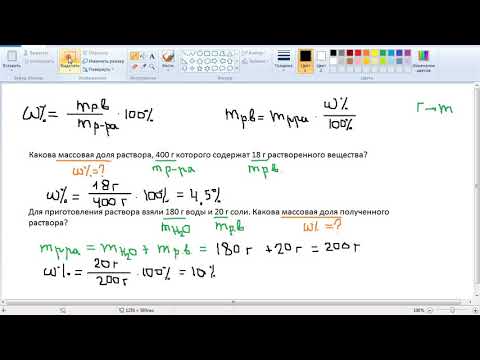
Вычисление массовой доли растворенного вещества
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Решение задач по химии на определение массы вещества, молярной массы растворённого вещества
Задание 175.
Вычислите массовую долю (%) водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100,26 oС. Эбулиоскопическая константа воды 0,520. Ответ: 8,25%.
Решение:Температура кипения чистой воды равна 100 oС, следовательно, = 100,26 — 100 = 0,260. М( С6Н12О6) = 180 г/моль. Находим массу С6Н12О6 приходящуюся на 1000 г воды используя формулу:
Е – эбулиоскопическая константа; m – масса растворённого вещества; М – молярная масса растворённого вещества; повышение температуры кипения раствора.
Отсюда
Общая масса раствора, содержащего 90 г глюкозы, составляет 1000 + 90 = 1090 г. Процентное содержание глюкозы в данном растворе находим из соотношения:
m(B) – масса растворённого вещества m(смеси); m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 8,25%.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Расчет массы вещества в растворе
Задание 176.
Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1°. Ответ: 3,91 г.
Решение:
Для нахождения массы мочевины используем уравнение:
К – криоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М((С6Н5ОН) = 94 г/моль.]; – понижение температуры замерзания раствора.
Отсюда
Ответ: 3,9 г.
Задание 177.
Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26°? Эбулиоскопическая константа воды 0,52°. Ответ: 7,5 г.
Решение:
Для нахождения массы мочевины используем уравнение:
Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(NH2)2CO = 60 г/моль]; – повышение температуры кипения раствора.
Отсюда
Ответ: 7,5 г
Видео:Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

Молярная масса растворенного вещества
Задание 178.
При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 92 г/моль.
Решение:
Для расчета используем уравнение:
K – криоскопическая константа; m1 – масса растворённого вещества, 2,3 г; m2 – масса растворителя 125г; М – молярная масса растворённого вещества; – понижение температуры замерзания раствора.
Ответ: 92 г/моль
Видео:Массовая и объёмная доли компонентов в смеси | Химия 8 класс #25 | ИнфоурокСкачать

Вычисление температуры кипения раствора
Задание 179.
Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбулиоскопическая константа воды 0,52°. Ответ. 101,625 °С.
Решение:
Рассчитаем повышение температуры кипения пропилового спирта по уравнению, получим::
Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 15 г; m2 – масса растворителя 85 (100 -15 = 85) г; М – молярная масса растворённого вещества [М(С3Н7ОН) = 60 г/моль]; – повышение температуры кипения раствора.
Вода кипит при 100 оС, следовательно, температура кипения раствора равна: 100 — 1,625 = 101,625 оС.
Ответ: 101,625 оС.
Рассчет массы метанола в растворе
Задание 180.
Вычислите массовую долю (%) водного раствора метанола СН3ОН, температура кристаллизации которого -2,79 °С. Криоскопическая константа воды 1,86°. Ответ: 4,58%.
Решение:
Температура кристаллизации чистой воды равна 0оС, следовательно, = 0 — (-2,79) = 2,790. М(СН3ОН) = 32 г/моль. Находим массу СН3ОН, приходящуюся на 1000 г воды используя формулу:
К – криоскопическая константа; m1 – масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества; – понижение температуры замерзания раствора.
Тогда с учётом того, что m2 равно 1000 г, получим:
Общая масса раствора, содержащего 48 г метанола, составляет 1000 + 48 = 1048 г. Процентное содержание сахара в данном растворе находим из соотношения:
m(B) – масса растворённого вещества m(смеси); m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 4,58%.
💥 Видео
Практическая работа №3 Приготовление раствора с определённой массовой долей растворённого веществаСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

МАССОВАЯ доля растворенного вещества / объяснение простыми словами / ХИМИЯ 8 классСкачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Массовая доля элементаСкачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

70. Массовая доля растворенного вещества в растворе (часть 1)Скачать

Приготовление раствора с заданной концентрациейСкачать

Массовая доля растворенного вещества в раствореСкачать

Вычисление массы растворённого вещества и растворителя | Химия 8 класс #26 | ИнфоурокСкачать

Вычисление массовой доли растворенного веществаСкачать

8 класс Химия Решение задач. Массовая доля вещества в растворе.Скачать

Вычисление массовой доли элементов в веществеСкачать

Массовая доля растворенного веществаСкачать

Расчеты массовой доли раствора для 7-9 класса (простые задачи)Скачать