Решение задач по химии на расчет температуры кипения и моляльной концентрации раствора
Задача 499.
В 200 г воды растворено: 1) 31 г карбамида СО(NH2)2; 2) 90 г глюкозы C6H12O6. Будет ли температура кипения этих растворов одинакова: а) да; б) нет?
Решение:
M(СО(NH2)2) = 60 г/моль, M(C6H12O6) = 180 г/моль. Для расчетов температур кипения растворов неэлектролитов используем уравнение:
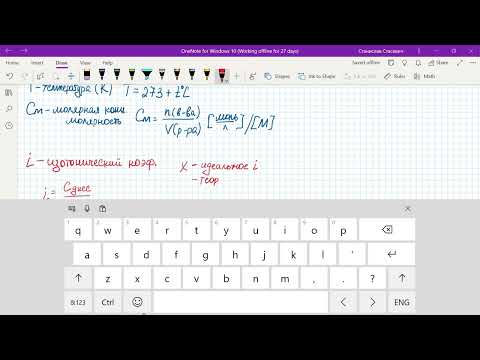
где СМ— моляльная концентрация m1 — масса растворённого вещества; m2 — масса растворителя; М – молярная масса растворённого вещества; Е – эбуллиоскопическая константа (для воды Е = 0,52); tкип — повышение температуры кипения.
Находим повышение температуры кипения растворов мочевины и глюкозы:
(tкип)[СО(NH2)2] = (0,52 . 31 . 1000)/((200 . 60) = 1,34;
(tкип)(C6H12O6) = (0,52 . 31 . 1000)/((200 . 180) = 0,45.
Так как для обоих растворов повышение температуры кипения растворов (tкип) различно, то температура кипения этих растворов неодинакова.
Ответ: б) нет.
Задача 500.
В 250 г органического растворителя содержатся (g) г растворенного неэлектролита с молекулярной массой (М). Криоскопическая постоянная растворителя равна К. Какое выражение для tкрист правильно: а) Kg/M; б) 4Kg/M; в) Kg/4M.
Решение:
Понижение температуры кристаллизации раствора определяется по уравнению:
tкрист = СМ . К
где СМ— моляльная концентрация m1 — масса растворённого вещества; m2 — масса растворителя; М – молярная масса растворённого вещества; К — криоскопическая константа. Подставив в уравнение данные задачи, получим выражение для tкрист:
Видео:задачи на коллигативные свойстваСкачать

Ответ: б).
Задача 501.
Некоторый водный раствор неэлектролита кипит при 373,52 К. Какова моляльная концентрация этого раствора: а) СМ = 1; б) СМ = 0,1; в) СМ = 0,01 моль на 1000 г Н2О?
Решение:
Из уравнения:
tкип = tкип(Н2О) + tкип
где
tкип (Н2О) = 373К (273+100=373), рассчитаем повышение температуры кипения раствора:
tкип = tкип — tкип (Н2О) = 373,52 = 373 = 0,52
Из уравнения:
tкип = СМ . Е,
где
CМ — моляльная концентрация Е – эбуллиоскопическая константа (для воды Е = 0,52), находим моляльную концентрацию, получим:
Ответ: а).
Задача 502.
Нужно приготовить раствор, содержащий в 1 л 0,5 моля NaCl, 0,16 моля KCl и 0,24 моля K2SO4. Как это сделать, имея в своем распоряжении только NaCl, KCl и Na2SO4?
Решение:
Найдём общее количество ионов в полученном растворе:
0,5М NaCl: n(Na+) = 0,5 моля, n(Cl—) = 0,5 моля;
0,16М KCl: n(K+) = 0,16 моля, n(Cl—) = 0,16 моля;
0,24М K2SO4: n(K+) = 0,48 моля (2 . 0,24 = 0,48), n(SO42-) = 0,24 моля.
Таким образом, в полученном растворе содержится следующее количество ионов:
n(SO42-) = 0,24 моля, n(K+ = 0,64 моля, n(Cl—) = 0,66 моля и n(Na+) = 0,5 моля.
Необходимое количество ионов (SO42-) можно получить из 0,24 молей Na2SO4, что даст 0,48 молей ионов Na+. Недостающее количество ионов Na+ можно взять из 0,02 молей NaCl (0,50 – 0,048 = 0,02), что даст 0,02 моля ионов (K+). Тогда недостающее количество ионов Cl— можно взять, если прибавить 0,64 моля KCl (0,66 – 0,02 = 0,64), что даст 0,64 моля ионов (K+), необходимое количество для полученного раствора.
Таким образом, необходимо взять 0.24 моля Na2SO4, 0,02 моля NaCl и 0,64 моля KCl.
Ответ: 0.24 моля Na2SO4, 0,02 моля NaCl и 0,64 моля KCl.
📺 Видео
Коллигативные свойства растворовСкачать
8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

3 6 Осмос Коллигативные свойства растворовСкачать

Закон РАУЛЯСкачать

Кипение, удельная теплота парообразования. 8 класс.Скачать

ЗАДАЧИ НА РАСТВОРИМОСТЬ ЗА 5 МИНУТ?😳|AllesСкачать

Изменение точки кипения и замерзанияСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

3 2 Замерзание и кипение растворовСкачать

Молярная концентрация. 10 класс.Скачать

Решение задач на теории растворов. 11 класс.Скачать

MB2 . Как решать задачи на приготовление растворовСкачать

Алгоритм: Убираем переедание и тягу к сладкомуСкачать

Решение задач на теории растворов. 11 класс.Скачать

Решение задач по теме "Растворы" | Химия, онлайн-форумСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Коллигативные свойства растворов неэлектролитовСкачать

Плавление и кристаллизация твердых тел, температура плавления, удельная теплота плавления. 8 класс.Скачать

