Особенности строения, свойства и номенклатура комплексных соединений
Задача 182.
Для приведенных формул комплексных соединений: [Pt(NH3)4Br2]Cl2, [Ni(NH3)6]2[Fe(CN)6].
а) укажите внутреннюю и внешнюю координационные сферы, комплексообразователь и лиганды;
б) определите заряд комплекса, степень окисления и координационное число комплексообразователя;
в) классифицируйте соединения;
г) приведите названия;
д) напишите уравнения первичной и вторичной диссоциации и выражения констант
равновесия.
Решение:
1. [Pt(NH3)4Br2]Cl2
а) внутрення сфера — [Pt(NH3)4Br2]2+, внешня координационная сфера — 2Сl—;
б) заряд комплекса (2+), степень окисления Pt (+4) и координационное число комплексообразователя (6);
в) катионная комплексная соль;
г) дибромотетраамминплатина(IV)хлорид или хлорид дибромоететраамминплатины (IV);
д) уравнение первичной диссоциации:
[Pt(NH3)4Br2]Cl2 = [Pt(NH3)4Br2]2+ + 2Сl—
уравнение вторичной диссоциации:
[Pt(NH3)4Br2]2+ = Pt + 4NH3 + 2Br—
выражение константы равновесия:
Кн = [Pt4+][NH3]4[Br—]2/[[Pt(NH3)4Br2]2+].
2. [Ni(NH3)6]2[Fe(CN)6]
а) внутрення сфера — [Fe(CN)6]4-, внутренняя (внешня) координационная сфера — 2[Ni(NH3)6]2+;
б) заряд комплексного аниона (4-), степень окисления Fe (+2) и координационное число комплексообразователя (6); заряд комплексного катиона (2+), степень окисления Ni (+2) и координационное число комплексообразователя (6);
в) двойной (ион-катионный) комплекс;
г) гексацианоферрат(II) 2 гексаамминникеля(II) или гексаамминникеля(II) гексацианоферрат(II)
д) уравнение первичной диссоциации:
[Ni(NH3)6]2[Fe(CN)6] = 2[Ni(NH3)6]2+ + [Fe(CN)6]4-
1) уравнение вторичной диссоциации:
[Ni(NH3)6]2+ = Ni2+ + 6NH3
Видео:Получение комплексных соединенийСкачать

1) выражение константы равновесия:
Кн = [Ni2+][NH3]6/[[Ni(NH3)6]2+]
2) уравнение вторичной диссоциации:
[Fe(CN)6]4- = Fe2+ + 6CN—
1) выражение константы равновесия:
Кн = [Fe2+][CN—]6/[[Fe(CN)6]4-]
Задача 183.
Надо назвать соединения, определить заряд комплекса и комплексообразователя в следующих соединениях. Написать выражение для константы нестойкости и реакцию диссоциации координационного соединения. Определить тип гибридизации и структурную форму комплекса.
(1.[Co(H2O)6]Cl3; 2.[Pt(H2O)(NH3)Cl2]; 3.Ca[PtCl6]; 4.[Pt(H2O)(NH3)I2].)
Решение:
1. [Co(H2O)6]Cl3
Название — хлорид гексааква хрома (III), заряд комплекса — (3+), заряд комплексообразователя Со — (3+).
Выражение константы нестойкости:
Кн = [Со3+][Н2О]6/[[Co(H2O)6]3+].
Видео:Комплексные соединения. 1 часть. 11 класс.Скачать

Уравнение первичной диссоциации:
[Co(H2O)6]Cl3 = [Co(H2O)6]3+ + 3Сl—
уравнение вторичной диссоциации:
[Co(H2O)6]3+ = Co3+ + 6H2O.
Со3+ имеет d2sp3-гибридизацию.
[Cr(Н2О)6]3+ имеет октаэдрическую конфигурацию.
2.[Pt(H2O)(NH3)Cl2] и 4.[Pt(H2O)(NH3)I2]
Видео:Комплексные соединения, 1982Скачать

всё тоже только в названии вместо дихлоро… нужно дииодо…
дихлороамминакваплатина(II), заряд комплекса — (0), заряд комплексообразователя Pt — (2+).
Кн = [Pt2+][Н2О][NH3][Cl—]2/[Pt(H2O)(NH3)Cl2].
[Pt(H2O)(NH3)Cl2] = Pt2+ + H2O + NH3 + 2Сl—
Pt2+ — dsp2-гибридизация. Плоскоквадратная структура комилекса.
3.Ca[PtCl6]
гексахлороплатинат(IV) кальция, заряд комплекса — (2-), заряд комплексообразователя Pt — (4+).
Выражение константы нестойкости:
Kн = [Pt4+][Cl—]6/[[PtCl6]2-].
Видео:Комплексные соединения. 2 часть. 11 класс.Скачать

Уравнение первичной диссоциации:
Ca[PtCl6] = Ca2+ + [PtCl6]2-
уравнение вторичной диссоциации:
[PtCl6]2- = Pt4+ + 6Cl-.
Pt4+ имеет d2sp3-гибридизацию.
[PtCl6]2- имеет октаэдрическую конфигурацию.
Комплексные ионы
Задача 184.
Как объяснить зеленую окраску раствора комплексного иона [Cu(H2O)2Cl4]2- и фиолетовую окраску раствора комплексного иона [Cu(еn)2]2+?
Решение:
При наличии на d-подуровне в ионе Cu2+ 9 электронов суммарный спин в слабом и сильном поле получается одинаковым. Следовательно, на верхнем энергетическом подуровне имеется вакансия. Переход электронов с t2g на eg подуровень при поглощении кванта света и определяет окраску соединений меди (II). Различная окраска комплексных соединений комплексного иона Cu2+ зависит от характера лигандов. Аквакомплексы меди (П) имеют в водном растворе голубую окраску, введение во внутреннюю сферу комплекса хлорид-ионов приводит к образованию смешанно-лигандного комплекса, что и вызывает изменение окраски раствора на зеленую. Объяснить это можно тем, что слабые лиганды Cl— и H2O. При этом октаэдрический, парамагнитный, внешнеорбитальный (высокопассивный) комплексный ион [Cu(H2O)2Cl4]2- поглощает длину волн видимого спектра в диапозоне 510-550 нм.
Парамагнитный внутриорбитальный ион [Cu(еn)2]2+, образован лигандом сильного поля (еn), имеет линейную геометрическую структуру, гибридизация sp2. Ион [Cu(H2O)2Cl4]2- имеет более высокий параметр поглощения энергии, чем ион [Cu(еn)2]2+ и будет поглощать электромагнитные волны в диапазоне 390 — 440 нм, что и будет обусловливать фиолетовую окраску раствора.
Задача 185.
Даны растворы комплексных ионов с одинаковой молярной концентрацией: [Ni(NH3)4]2+(С1) и [Ni(CN)4]2-(С2). В каком из двух растворов концентрация никеля будет больше? Напишите уравнения вторичной диссоциаци этих комплексных ионов.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Ni(NH3)4]2+ больше чем у иона [Ni(CN)4]2- (9,1•10-8 > 1,0•10-31, то концентрация комплексообразователя (Ni) в растворе [Ni(NH3)4]2+ больше чем в растворе [Ni(CN)4]2-.
[Ni2+](C1) = 9,1 • 10-8 моль/л); [Ni2+](C2) = 1,0 • 10-31 моль/л).
Следовательно, [Ni2+](C1) > [Ni2+](C2).
Вторичная диссоциация комплексных ионов:
[Ni(NH3)4]2+ = Ni2+(C1) + 4NH3;
[Ni(CN)4]2- = Ni2+(C2) + 4CN—.
Задача 186.
Даны растворы комплексов с одинаковой молярной концентрацией: K2[Cd(CN)4](С1) и Cd[Co(CN)4](С2). Определите концентрации комплексообразователй и лигандов в этих растворах? Составьте схемы полной диссоциации этих комплексов.
Решение:
1. Схемы полной диссоциации комплексов:
Видео:Номенклатура комплексных соединений. 11 класс.Скачать

K2[Cd(CN)4] = 2K+ + Cd2+ + 4CN—;
Cd[Co(CN)4] = Co2+ + Cd2+ + 4CN—.
2. Определение концентраций комплексообразователей и лигандоов
Так как молярные концентрации комплексных соединений одинаковы, то концентрационными величинами можно пренебречь, тогда
[Cd2+](C1) = 1,4•10-17 моль/л), [CN—](C1) = 4 • 1,4•10-17 моль/л;
[Cd2+](C2) = 7,8•10-6 моль/л), [CN—](C2) = 4 • 7,8•10-6 моль/л.
Выводы:
1) [Cd2+](C2) → [Cd2+](C1);
2) [CN—](C2) → [CN—](C1).
📸 Видео
2.11. Изомерия комплексных соединенийСкачать

Семинар "Строение комплексных соединений"Скачать
Свойства комплексных соединений. 11 класс.Скачать

Ерёмин В. В. - Общая химия - Комплексные соединения (Лекция 7)Скачать

Классификация комплексных соединений. 11 класс.Скачать

Румянцева М.Н.- Общая и неорганическая химия. Лекции - 17. Комплексные соединения (продолжение)Скачать

Комплексные соединения. Строение и классификация. Теория А. Вернера.Скачать

Комплексные соединенияСкачать

Комплексные соединенияСкачать

Комплексные соединенияСкачать
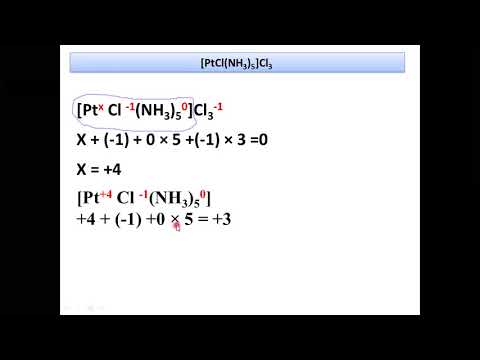
Видео поведение комплексных соединений в растворах.Скачать
Комплексные соединения. Определяем заряд комплексного иона и валентность комплексообразователя.Скачать

Константа нестойкости и диссоциация комплексных соединенийСкачать

