Свойства элементов подгруппы железа
Задание 424
Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ноны Ее2+ и Fe3+ в растворе? Составьте молекулярные и ионно-молекулярные уравнения реакций.
Решение:
а) Электронная конфигурация атома железа имеет вид: …3d64s2. Поэтому железо может проявлять следующие степени окисления: +2 и +3. Атом железа может отдавать два электрона с 4s-подуровня (при этом будет иметь электронную конфигурацию…3d6) и дополнительно к двум 4s-электронам атом железа может отдать один d-электрон (при этом будет иметь электронную конфигурацию…3d5). В растворах более устойчивы соединения железа со степенью окисления железа +3. Известны соединения железа со степенью окисления + 6, например, BaFeO4.
б) Ионы Fe2+ можно обнаружить действием комплексной солью K3[Fe(CN)6] – красная кровяная соль [или гексацианоферрат(III) калия]; при взаимодействии её с солями железа (II) образуется тёмно-синий осадок (турнбулева синь). Молекулярное уравнение реакции имеет вид:
3FeCl2 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]↓ + 6KCl
Ионно-молекулярное уравнение реакции:
3Fe2+ + [Fe(CN)6]3- = Fe3[Fe(CN)6]↓
в) Ионы Fe3+ можно открыть с помощью тиоцианата калия или жёлтой кровяной соли:
1). Открытие ионов Fe3+ с помощью тиоцианата калия или аммония:
Молекулярное уравнение реакции:
FeCl3 + 3KNCS = Fe(NCS)3 + 3KCl;
кроваво-красная
окраска
Ионно-молекулярное уравнение реакции можно не писать, так как осадка не образуется.
2). Открытие ионов Fe3+ с помощью жёлтой кровяной соли:
Молекулярное уравнение реакции:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]↓ + 12KCl
В результате реакции образуется тёмно-синий осадок (берлинская лазурь) Fe4[Fe(CN)6].
Ионно-молекулярное уравнение реакции:
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]↓
Задание 425
Чем отличается взаимодействие гидроксидов кобальта (III) и никеля (III) с кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
Гидроксида железа (III) Fe(OH)3 – амфотерный гидроксид, который взаимодействует с кислотами с образованием аквакомплекса [Fe(H2O)6]3+:
Fe(OH)3 + 3HCl + 3H2O = [Fe(H2O)6]Cl3 (молекулярная форма);
Fe(OH)3 + 3H+ + 3H2O = [Fe(H2O)6]3+ (ионно-молекулярная форма).
При взаимодействии Со(ОН)3 и Ni(OH)3 с кислотами происходить не образование солей кобальта (III) и никеля (III), а восстановление Со и Ni до двухвалентного состояния, сопровождающееся выделением свободного кислорода:
а) 4Со(ОН)3 + 8HCl = 4CoCl2 + 10H2O + O2↑ (молекулярная форма);
4Со(ОН)3 + 8H+ = 4Co2+ + 10H2O + O2↑ (ионно-молекулярная форма).
б) 4Ni(ОН)3 + 8HCl = 4NiCl2 + 10H2O + O2↑ (молекулярная форма);
4Ni(ОН)3 + 8H+ = 4Ni2+ + 10H2O + O2↑ (ионно-молекулярная форма).
Задание 426
Могут ли в растворе существовать совместно следующие вещества: а) FeCl3 и SnCl2; б) FeSO4 и NаОН; в) FeCl3 и К3[Fe(CN)6]? Для взаимодействующих веществ составьте уравнения реакций.
Решение:
а) FeCl3 и SnCl2 как сильные электролиты диссоциируют на ионы полностью
(FeCl3 → Fe3+ + 3Cl—; SnCl2 → Sn2+ + 2Cl—), поэтому в растворе находятся ионы Fe3+, Sn2+, Cl—, которые между собой не связываются. Значит, FeCl3 и SnCl2 могут в растворе совместно существовать.
б) FeSO4 и NаОН как сильные электролиты диссоциируют на ионы полностью
(FeSO4 → Fe2+ + SO42-; NaOH → Na+ + OH—), поэтому в растворе находятся ионы Fe2+, Na+, SO42- и OH—. Ионы Fe2+ и ОН— связываются друг с другом с образованием малорастворимого Fe(OH)2, при этом выпадает осадок. Значит, FeSO4 и NаОН не могут в растворе совместно существовать, потому что происходит реакция:
FeSO4 + 2NаОН = Fe(OH)2↓ + Na2SO4
в) FeCl3 и К3[Fe(CN)6] в водных растворах диссоциируют с образованием ионов Fe3+, K+, Cl— и [Fe(CN)6]3-. Эти ионы в водных растворах друг с другом не связываются с образованием осадка, газа или слабого электролита, поэтому FeCl3 и К3[Fe(CN)6] в водных растворах могут совместно существовать.
Задание 430
Феррат калия К2FeO4 образуется при сплавлении Fe2O3 с калийной селитрой КNO3 в присутствии КОН. Составьте электронные и молекулярное уравнения реакции.
Решение:
Уравнение реакции сплавления Fe2O3 с калийной селитрой КNO3 в присутствии КОН:
Уравнения электронного баланса:
2Fe3+ + 3N5+ = 2Fe6+ + 3N3+
Fe2O3+3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
📺 Видео
#424 Номер 424 из Демидовича | Предел функцииСкачать

9 класс. Железо. Соединения железа. Ч2Скачать

Химия 9 класс : Соединения железаСкачать

[EN] Стальные соединения | Американский национальный стандарт ANSI/AISC 360-16Скачать
![[EN] Стальные соединения | Американский национальный стандарт ANSI/AISC 360-16](https://i.ytimg.com/vi/EAgzwX-MRYw/0.jpg)
#424.1 Номер 424.1 из Демидовича | Предел функцииСкачать

Расчёт стальных соединений по американской норме ANSI/AISC 360-16Скачать
9 класс § 19 "Железо и его соединения"Скачать

[EN] Вебинар | Расчет стальных соединений AISC 360-16 в RFEM 6Скачать
![[EN] Вебинар | Расчет стальных соединений AISC 360-16 в RFEM 6](https://i.ytimg.com/vi/uqlO2fYfAtQ/0.jpg)
Урок 6. Треугольники, четырёхугольники, многоугольники. ОГЭ. Вебинар | МатематикаСкачать

БЕСКОНЕЧНАЯ ФЕРМА ЖЕЛЕЗНЫХ ГОЛЕМОВ ► LP ТехноМагия 3 #56 ► Майнкрафт Выживание с МодамиСкачать

Математика 4 класс (Урок№30 - Задачи на увеличение (уменьшение) числа в несколько раз.)Скачать

[DE] CP 001147 | 3D соединение стальных конструкций с твердотельными элементами RFEM, НидерландыСкачать
![[DE] CP 001147 | 3D соединение стальных конструкций с твердотельными элементами RFEM, Нидерланды](https://i.ytimg.com/vi/0Gts_1YLRw4/0.jpg)
244. Степень окисления серы в различных соединенияхСкачать

Шестнадцатая проблема Гильберта -- Илья ЩуровСкачать

Энкодер токарного 100 линий Сбой и пропуск шаговСкачать

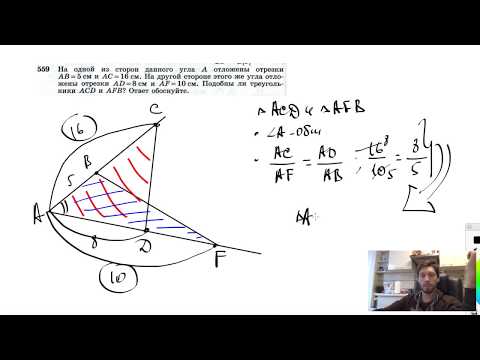
№559. На одной из сторон данного угла А отложены отрезки АВ=5 см и АС = 16 см. На другойСкачать
[ГАЙД] КАК БЫСТРО ОДЕТЬ 460 ИЛВЛ ЗА 24 ЧАСА WORLD OF WARCRAFT BFA WOW 8.3Скачать
![[ГАЙД] КАК БЫСТРО ОДЕТЬ 460 ИЛВЛ ЗА 24 ЧАСА WORLD OF WARCRAFT BFA WOW 8.3](https://i.ytimg.com/vi/smz6tuG8r4k/0.jpg)
№146. Отрезки АВ и CD — диаметры окружности с центром О. Найдите периметр треугольника AOD, еслиСкачать

Урок 452. Задачи на гипотезу де Бройля - 1Скачать

