Определение реакции среды раствора соли
Задача 594.
Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
Решение:
K(NH4OH) = 1,8 . 10-5; K(HCN) = 7,9 . 10-10; K(HF) = 6,6 . 10-4; K(H2S) = 6 . 10-8.
Так как соли образованы слабыми основаниями и слабыми кислотами, то при взаимодействии с водой они гидролизуются как по катиону, так и по аниону, В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих данную соль.
а) NH4CN — соль слабого основания и слабой кислоты, поэтому гидролизуется как по катиону, так и по аниону. Но так как K(HCN) < K(NH4OH) [(7,9 . 10-10) < (1,8 . 10-5)], то гидролизу преимущественно будут подвергаться анионы соли и реакция раствора будет преимущественно слабощелочной, рН > 7:
CN— + H2O ⇔ HCN + OH—.
б) NH4F. Так как K(HF) > K(NH4OH) [(6,6 . 10-4) < (1,8 . 10-5)], то гидролизу преимущественно будут подвергаться катионы соли и реакция раствора будет преимущественно слабокислой рН < 7:
NH4+ + H2O ⇔ NH4OH + H+.
в) (NH4)2S. Так как K(H2S) < K(NH4OH) [(6 . 10-8) < (1,8 . 10-5)], то гидролизу преимущественно будут подвергаться анионы соли и реакция раствора будет преимущественно слабощелочной, рН > 7:
S2- + H2O ⇔ HS + OH—.
Задача 595.
При рН < 3,1 индикатор метиловый красный окрашен в красный цвет, при рН > 6,3 — в желтый, при промежуточных значениях рН — в оранжевый цвет. Какова будет окраска индикатора в 0,1 М растворе ?
Решение:
K(NH4OH) = 1,8 . 10-5.
Уравнение гидролиза NH4Br:
NH4+ + H2O + NH4OH + H+.
Находим константу гидролиза:
Видео:Гидролиз солей. Опыт 2. Определение реакции среды в растворах солейСкачать

Теперь найдём степень гидролиза:
Находим концентрацию ионов водорода:
[H+] = h . CM = (7,46 . 10-5) . (1 . 10-1) = 7,46 . 10-6.
Следовательно,
pH = -lg[H+] = -lg7,46 . 10-6 = 6 — lg7,46 = 6 — 0,87 = 5,13.
Так как pH > 3,1, но < 5,13, то есть имеет промежуточное значение, значит, раствор будет окрашен в оранжевый цвет.
Ответ: оранжевый.
Задача 596.
Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 — сильно-щелочную реакцию. Объяснить эти факты и мотивировать их соответствующими ионно-молекулярными уравнениями.
Решение:
а) Так как NaH2PO4 — соль сильного основания и слабой кислоты, то гидролиз протекает по аниону:
H2PO4— + H2O ⇔ H3PO4 + OH—.
В растворе проходит и диссоциация образовавшейся фосфорной кислоты:
H3PO4 ⇔ H+ + H2PO4—.
При гидролизе данной соли образуется ортофосфорная кислота, которая при диссоциации даёт в раствор дополнительное количество ионов водорода, которых намного больше, чем гидроксид-ионов, что и придаёт раствору слабокислую реакцию. Это можно объяснить тем, что в рассмотренном примере константа диссоциации H3PO4 превышает константу гидролиза аниона H2PO4—, поэтому раствор соли имеет слабокислую реакцию.
б) Так как Na3PO4 — соль сильного основания и слабой кислоты, то гидролиз протекает по аниону:
PO43- + H2O ⇔ HPO42- + OH—.
В растворе проходит и диссоциация образовавшейся фосфорной кислоты:
H3PO4 ⇔ H+ + H2PO4—
В рассмотренном примере одновременно протекают два процесса: гидролиз соли, идущий с образованием гидроксид-ионов; диссоциация кислоты, идущая с образованием ионов водорода. Так как константа гидролиза аниона HPO42- намного превышает константу диссоциации кислоты H3PO4, то в растворе будет избыток гидроксид-ионов, что и предаёт раствору сильно-щелочную реакцию.
💥 Видео
Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз солей. 9 класс.Скачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Гидролиз солей. Опыт 1. Окраска индикаторов в различных средахСкачать

11 класс. Гидролиз солей.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

Вычисление рН в растворах солейСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Все реакции гидролиза солей для ЕГЭ. Необратимый гидролиз за 4 минутыСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать
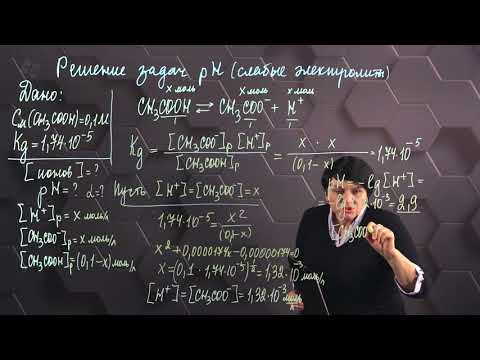
pH раствора солиСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Диссоциация. Гидролиз солей. pHСкачать