Как правильно рассчитать концентрацию ионов водорода и рН в растворе серной кислоты
Задача 101.
Вычислите [Н+] и рН 0,01 М и 0,05 Н растворов Н2SO4.
Решение:
CM(Н2SO4) = 0,01 М;
CH(Н2SO4) = 0,05 М;
a) Вычисление [Н+] и рН 0,01 М раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,01) = 2 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg2 · 10-2 = 2 — lg2 = 2 — 0,30 = 1,70.
б) Вычисление [Н+] и рН 0,05 Н раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна ее нормальности.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

[Н+] = СН(Н2SO4) = (1 · 0,05) = 5 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg5 · 10-2 = 2 — lg5 = 2 — 0,70 = 1,30.
Ответ: а) [Н+] = 2 · 10–2 моль/дм3; рН = 1,70; б) [Н+] = 5 · 10–2 моль/дм3; рН = 1,30.
Задача 102.
Вычислите [Н+] и рН раствора Н2SO4 с массовой долей кислоты 0,5% (р = 1,00 г/см3).
Решение:
М(Н2SO4) = 98 г/моль;
w% = 0,5% или 0,005;
р = 1,00 г/см3.
1. Рассчитаем молярность раствора кислоты
CM(Н2SO4) = (w% · p · 1000)/М(Н2SO4) = (0,005 · 1,00 г/см3 · 1000 cм3)/98 г/моль = 0,05 M.
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,05) = 1 · 10-1 моль/дм3;
рН = -lg[Н+] = -lg1 · 10-1 = 1 — lg2 = 1 — 0,00 = 1,00.
Ответ: [Н+] = 0,1 моль/дм3;рН = 1,00.
Задача 103.
Вычислите [Н+] и рН 0,5 М раствора гидроксида аммония.
Решение:
КD(NH4OH) = 1,76 · 10–5;
CM(NH4OH) = 0,5 М.
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Схема диссоциации NH4OH:
NH4OH ⇔ NН4+ + OH–
Поскольку КD(NH4OH) << CM(NH4OH) так как (1,76 · 10–5) << 0,5, то можно считать, что равновесная концентрация недиссоциированного основания равна его общей концентрации: СМ(NH4OH) = 0,5 моль/дм3.
Для слабых оснований [H+] вычисляют по формуле:
рН = -lg[Н+] = -lg3,37 · 10-12 = 12 — lg3,37 = 12 — 0,53 = 11,47.
Ответ: [Н+] = 3,37 · 10–12 моль/дм3;рН = 11,47.
🎬 Видео
Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать
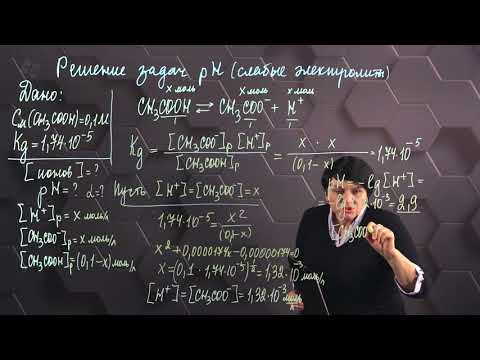
Расчет рН растворов сильных и слабых оснований. Химия для поступающих.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Способы выражения концентрации растворов. 8 класс.Скачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Задача на произведение растворимости ПР=[Ag+]2[CrO4(2-)]Скачать
![Задача на произведение растворимости ПР=[Ag+]2[CrO4(2-)]](https://i.ytimg.com/vi/lBMm8M_2ndI/0.jpg)
Ионное произведение воды. Водородный показатель. 11 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Молярная концентрация. 10 класс.Скачать

pH и буферные растворы | Медицинская химия | МедвузаСкачать

Ионная сила раствора. Теория (кратко) + задача.Скачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Задачи на концентрациюСкачать
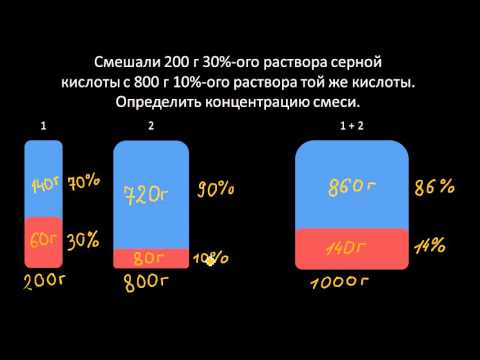
Решение задач на концентрации растворовСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Задача1Скачать

