- Вычисление значений энтальпии, энтропии и энергии Гиббса химических реакций
- Изменение энтропии для химических процессов
- Вычисление энтальпии реакции
- Определение температуры наступления равновесия реакции
- Определение направления химической реакции
- Расчет энергии Гиббса реакции образования беспорядочного клубка лизин
- 💡 Видео
Вычисление значений энтальпии, энтропии и энергии Гиббса химических реакций
Изменение энтропии для химических процессов
Задача 55.
Вычислите изменение энтропии для химических процессов, протекающих по уравнениям:
a) 2NO(г) + O2(г) = 2NO2(г);
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Решение:
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.).
a) 2NO(г) + O2(г) = 2NO2(г)
Для этой реакции составaим уравнение расчета изменения энтропии в стандартных условиях:
ΔS° = [2 · S°NO2(г)] – [2 · S°NO(г) + S°O2(г)].
По табличным данным установим значения энтропий (S°) участников процесса (Дж/моль·К):
Видео:Энергия ГиббсаСкачать

S°NO2(г) = 240,2; S°NO(г) = 210,6; S°O2(г) = 205,0.
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
ΔS° = (2 · 240,2) – [(2 · 210,6) + 205,0] = -145,8 Дж/(моль·К).
Заметим при этом, что отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Для этой реакции составим уравнение расчета изменения энтропии в стандартных условиях:
ΔS° = [2 · S0SO2(г) + 2 · S0H2O(ж)] – [2 · S0H2S(г) + 3S°O2(г)].
По табличным данным установим значения энтропий (S0) участников процесса (Дж/моль·К):
S°SO2(г) = 248,1; S°H2O(ж) = 70,1; S°H2S(г) = 205,7; S°O2(г) = 205,0.
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
Видео:Внутренняя энергия и энтальпия. Расчет энтальпии. Практическая часть. 10 класс.Скачать

ΔS° = [(2 · 248,1) + (2 .70,1)] – [(2 · 205,7) + (3 · 205,0)] = -390,0 Дж/(моль·К).
Таким образом, отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
Вычисление энтальпии реакции
Задача 56.
Экспериментально установлено, что при взаимодействии 2,3 г натрия с водой выделяется 14,0 кДж теплоты. Вычислите энтальпию реакции.
Решение:
m(NaOH) = 2,3 г;
М(NaOH) = 46 г/моль;
Q = 14,0 кДж.
Уравнение реакции:
2,3 г 14,0 кДж
2Na + 2H2O = 2NaOH + H2; ΔH = ?
2* 43 г
Вычисляем энтальпию реакции из пропорции, получим:
2,3 г — 14,0 кДж
46 г —- х кДж
х = (46 . 14)/2,3 = 280 кДж.
ΔH = 280 кДж.
Можно проверить, используя табличные данные и следствие из закона Гесса, получим:
∆H°(Н2О) = -285,8 кДж;
∆H°(NaOH) = -425,6 кДж.
∆H° = [2∆H°(NaOH) — 2∆H°(Н2О)] = 2(-425,6) — 2(-285,8) = 280 кДж.
Задача 57.
1. Определить энтальпию образования CaHPO4(к), если термохимическое уравнение реакции имеет вид:
2Ca(OH)2(к) + P2O5(к) = 2CaHPO4(к) + H2O(г); ∆H = –1587 кДж.
Решение:
∆H°Cа(OН)2(к) = -985,1 кДж/моль;
∆H°Р2О5(к) = -1507,2 кДж/моль;
∆H°Н2О(г) = -241,81 кДж/моль;
∆H°CаНРО4(к) = ?
Согласно 2-му следствию из закона Гесса, изменение энтальпии химического процесса (ΔН°) определяется как разность сумм энттльпий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтальпии реакции получим:
∆Н(х.р.) = ∑∆Н(обр.прод.) — ∑∆Н(обр.исх.).
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Тогда
∆H° = [2∆H°CаНРО4(к) + ∆H°Н2О(г)] — 2[∆H°Cа(OН)2(к) + ∆H°Р2О5(к)];
∆H° = [2x + ∆H°Н2О(г)] — 2[∆H°Cа(OН)2(к) + ∆H°Р2О5(к)];
–1587 = 2х + (-241,81) + [2(-985,1) + 1507,2];
–1587 = 2х + 3235,59;
х = -23713 кДж/моль.
Ответ: ∆H°CаНРО4(к) = -23713 кДж/моль.
Р.S. Слишком большое расхождение с табличными данными (-1808,6 кДж/моль) указывает на то, что ∆H° = –1587 кДж, указанное значение в условии задачи, иное (-381,6 кДж/моль).
Определение температуры наступления равновесия реакции
Задача 58.
При какой температуре наступит равновесие системы: CO(г) + 2H2(г) = CH3OH(ж)?
Решение:
∆H°CO(г) = -110,52 кДж/моль;
∆H°CH3OH(ж) = -238,9 кДж/моль;
S°(СО) = 197,55 Дж/моль . К;
S°(Н2) = 130,52 Дж/моль . К;
S°(СН3ОН) = 126,78 Дж/моль . К.
1. Находим ∆H°х.р. для данной системы.
Согласно 2-му следствию из закона Гесса, изменение энтропии химического процесса (ΔН°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆H°х.р. = ∑∆H°(прод.) — ∑∆H°(исходн.).
Тогда
∆H°х.р. = ∆H°CH3OH(ж) – [∆H°CO(г) + ∆H°H2(г)];
∆H°х.р. = -238,9 – (-110,52) + 0,0 = -128,38 кДж/моль.
2. Находим ∆S°х.р. для данной системы
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.).
Видео:Свободная энергия Гиббса и самопроизвольные реакции (видео 8) | Энергия| БиологияСкачать

Тогда
∆S°х.р. = S°CH3OH — S°CO – S°H2;
∆S°х.р. = 129,78 – 197,55 – 130,52 =
= -331,81 Дж/(моль . К) = -0,33181 кДж/(моль . К).
3. Находим температуру равновесия системы
Для расчета температуры равновесия системы используем формулу: ∆G° = ∆H° — T∆S°.
В состоянии равновесия системы ∆G° = 0.
В этом случае — 0 = ∆H° — T∆S°.
Тогда
∆H° = T∆S°
Отсюда
Т = ∆H/∆S° = -128,38 кДж/моль/-0,33181 кДж/(моль . К) =
= 386,9 К.
Ответ: равновесие системы наступит при 386,9 К.
Определение направления химической реакции
Задача 59.
Дано уравнение: Fe2O3 + 2Al = Al2O3 + 2Fe. Вычислить тепловой эффект реакции, изменение стандартной энергии Гиббса при температуре 25 °С. В каком направлении будет протекать данная реакция?
Решение:
∆H°Fe2O3(к) = -822 кДж/моль;
∆H°Аl2O3(к) = -1675,7 кДж/моль;
S°Fe2O3(к) = 87 Дж/(моль . K);
S°Al2O3(к) = 50,9 Дж/(моль . K);
S°Fe(к) = 164,4 Дж/(моль . K);
S°Al(к) = 27,15 Дж/(моль . K).
Видео:Решение задач на вычисление энергии Гиббса. 1 часть. 10 класс.Скачать

1. Расчет энтальпии реакции получим:
∆Н(х.р.) = ∑∆Н(обр.прод.) — ∑∆Н(обр.исх.);
∆Н(х.р.) = [∆Н°Al2O3(к)] – [∆Н°Fe2O3(к)];
∆Н(х.р.) = (-1675,7) — [-822] = –853,7 кДж.
2. Расчет энтропии реакции получим:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.);
∆S°(х.р.) = [S°Al2O3(к) + S°Fe(к)] — [S°Fe2O3(к) + S°Al(к)];
∆S°(х.р.) = (50,9 + 164,4) – (87 + 27,15) = 101,15 Дж/(моль·К) = 0,10115 Дж/(моль·К).
Переведем температуру из шкалы Цельсия в шкалу Кельвина: Т = 273 + 25 = 298 К. Для расчета ∆G°(298) воспользуемся уравнением:
∆G°(298) = ∆H° – T∆S°;
∆G°(298) = –853,7 – 298·(0,10115) = -883,8427 кДж.
Таким образом,∆G°(500) < 0, поэтому самопроизвольное протекание данного процесса при 25 °С возможно, то данная реакция может протекать в стандартных условиях.
Ответ: ∆Н(х.р.) = –853,7 кДж; ∆G°(298) = -883,8427 кДж.
Расчет энергии Гиббса реакции образования беспорядочного клубка лизин
Задача 60.
В отсутствии денатурирующих агентов константа равновесия Кр реакции образования беспорядочного клубка лизина при 298 К и рН = 7 равна 7,8. Рассчитать ∆G°298 и оценить биологический аспект полученной величины.
Решение:
Рассчитаем ∆G°298 из формулы ∆G° = –RTlnK, получим:
∆rG°298 = –RTlnK = -[8,314 Дж/(моль . К) . 298 K . ln7,8] = -(8,314 . 298 . ln7,8) = -(8,314 . 298 . 2,054) = -5089 Дж/моль.
Так как ∆G° имеет отрицательное значение, (∆G° < 0), то реакция протекает самопроизвольно в прямом направлении. Значит, реакция образования беспорядочного клубка лизина будет происходить при 298 К и рН = 7.
Если ∆G° равно нулю (∆G° = 0), то реакция находится в равновесном состоянии.
Если ∆G° положительно (∆G° > 0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
💡 Видео
Энергия Гиббса. Практическая часть. 10 класс.Скачать

Термодинамика. Решение задач. Энтальпия, энтропия, энергия ГиббсаСкачать

Энтропия. 10 класс.Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Энтальпия реакции. Решение задачи.Скачать

Внутренняя энергия и энтальпия. 10 класс.Скачать

Что такое Энтропия?Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

2 4 Свободная энергия ГиббсаСкачать

ФИЗХА 10-11 класс | Химическое равновесие, энергия Гиббса | Олимпиадные задачи по химииСкачать

Решение задач на вычисление энергии Гиббса. 2 часть. 10 класс.Скачать
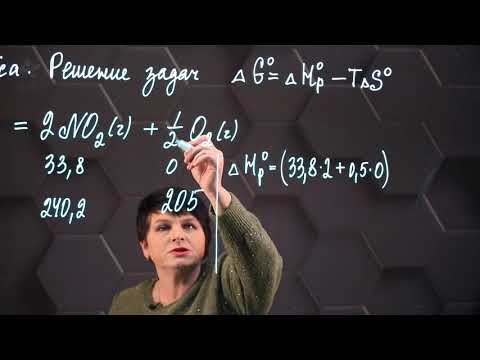
Закон Гесса. 10 класс.Скачать

Химическая термодинамикаСкачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

Энтропия и энергия гиббсаСкачать

