Определение возможности самопроизвольного протекания химической реакции
Определение возможности самопроизвольного протекания процесса алюмотермии
Видео:Энергия ГиббсаСкачать

Задача 1.
Определите возможность самопроизвольного протекания процесса алюмотермии:
Fe2O3(к) + 2Al(к) =Al2O3(к) + 2Fe(к)
при 298 К и 1000 К и стандартном состоянии всех веществ. Установите минимальную температуру, выше которой указанный процесс протекает самопроизвольно.
Решение:
Для определения возможности самопроизвольного протекания процесса нужно рассчитать энергию Гиббса ∆G0 реакции:
Fe2O3(к) + 2Al(к) =Al2O3(к) + 2Fe(к)
Для расчета энергии Гиббса используем закон Гесса:
∆G0х.р. = [∆G0обрAl2O3(к) + 2∆G0обрFe(к)] – [∆G0обрFe2O3(к) +2∆G0обрAl(к)].
При этом учтем, что ∆G0обрFe(к) = G0обрAl(к) = 0, а по табличным данным находим ∆G0обрAl2O3(к) = -1580,00 кДж/моль; ∆G0обрFe2O3(к) = -740,98 кДж/моль. Подставив найденные значения и произведя расчеты, получим:
∆G0х.р. = [-1580,00 – (-740,98)] кДж/моль = -839,02 кДж/моль.
Т.к. ∆G0х.р. < 0, то реакция при стандартных условиях (298 К) протекает самостоятельно.
Для расчета ∆G01000х.р. воспользуемся первым законом термодинамики, по формуле:
∆G0х.р. = ∆Н0 — Т∆S0
При этом в соответствии указанию условия задачи (все вещества находятся в стандартном состоянии) используем табличные значения ∆H0 и ∆S0 реагентов и продуктов при 298К:
∆H0обрAl2O3(к) = -1676,00 кДж/моль;
∆H0обрFe2O3(к) = -822,16 кДж/моль;
S0обрAl2O3(к) = 50,94 Дж/моль·К;
S0обрFe2O3(к) = 89,96 Дж/моль·К;
S0обрAl(к) = 42,69 Дж/моль·К;
S0обрFe(к) = 27,15 Дж/моль·К.
Подставим эти значения в выражения для ∆H0х.р. и ∆S0х.р. и произведем расчеты, получим:
∆H0х.р. = ∆H0обрAl2O3(к) — ∆H0обрFe2O3(к);
∆H0х.р. = [-1676,00 – (-822,16)] кДж/моль = -853,84 кДж/моль.
∆S0х.р. = [S0обрAl2O3(к) + 2·S0обрFe(к)] – [S0обрFe2O3(к) + 2·S0обрAl(к)];
∆S0х.р. = (50,94 + 2·27,15) – (89,96 + 2·42,69) Дж/моль·К = -70,10 Дж/моль·К.
Теперь находим ∆G0х.р., выражая ∆S0х.р. в кДж/(моль·К):
∆0G1000 = [-853,84 — 1000·(-70,10·10-3)] кДж/моль = -783,74 кДж/моль.
Т.к. ∆G01000 < 0, то реакция при 1000 К протекает самостоятельно.
Чтобы найти минимальную температуру, выше которой процесс протекает самопроизвольно, применим к системе условие Т = 0 К и тогда ∆G0х.р. = ∆Н0х.р. < 0. Таким образом, даже при отрицательных значениях температуры (а такие значения практически недостижимы) реакция будет протекать самопроизвольно.
Чтобы установить верхний предел температуры, при которой процесс перестает быть самопроизвольным, применим условие состояния химического равновесия:∆G = 0. Определяем температуру, при которой ∆G°х.р.= 0
Подставим в полученное выражение найденные значения ∆H0х.р.и ∆S0х.р. и, произведя расчеты, получим:
0 = ∆H0х.р. — Т∆S0х.р;
Т = (-783,74)/(-70,10·10-3) = 11180 К.
Таким образом, только при очень высокой температуре (Т = 11180 К) процесс алюмотермии невозможен.
Ответ: при 298 К и 1000 К процесс восстановления оксида железа (3) алюминием протекает самопроизвольно, т.к.∆G298< 0 и ∆Gх.р.< 0. Самопроизвольность процесса обеспечивается уже при температуре 0 К и прекращается при температуре выше 11180 К.
Определение возможности самопроизвольного протекания химического процесса
Задача 2.
Объясните, почему при стандартных условиях не протекает экзотермическая реакция:
Н2(г) + СО2(г) = СО(г) + Н2О(ж), ∆H1 = -2,85 кДж/моль; но протекает реакция:
2NO(г) +O2(г) = 2NO2(г), ∆H2 = -113,74 кДж/моль.
Решение:
Согласно первому закону термодинамики связь между энтальпией и энергией Гиббса химического процесса выражается уравнением: ∆H = ∆G + Т∆S. Отсюда ∆G = ∆H – Т∆S. Рассчитаем изменение энергии Гиббса обоих процессов, используя для расчета изменения энтропий ?S, взятые из таблиц.
Для первой реакции получим:
∆S0х.р.(1) = S0обрСО(г) + S0обрН2О(ж) — S0обрН2(г) — S0обрСО2(г);
∆S0х.р.(1) = (197,91 + 69,94 – 130,59 – 213,65) Дж/моль·К = -76,39 Дж/моль·К.
Для второй реакции результат будет следующим:
∆S0х.р.(2) = 2·S0обрNO2(г) — 2· S0обрNО(г) — S0обрО2(г);
∆S0х.р.(2) = (2·240,46 — 2·210,20 – 205,03) Дж/моль·К = -144,51 Дж/моль·К.
Теперь рассчитаем изменение энергии Гиббса при Т = 298 К для этих реакций:
∆G0х.р.(1) = ∆H1— Т∆S0х.р.(1);
∆G0х.р.(1) = -2,85 кДж/моль – 298 К·(-76,39·10-3 кДж/моль·К) = 19,91 кДж/моль;
∆G0х.р.(2) = ∆H2 — Т∆S0х.р.(2);
∆G0х.р.(2) = -113,74 кДж/моль – 298К·(-144,51·10-3 кДж/моль·К) = -70,68 кДж/моль.
Как свидетельствуют результаты расчетов,∆G0х.р.(1) > 0 и, значит, этот процесс самопроизвольно протекать не будет, зато ∆G0х.р.(2) < 0, что свидетельствует о самопроизвольности процесса при стандартных условиях.
Ответ: при стандартных условиях не протекает реакция восстановления диоксида углерода водородом, т.к. для неё ∆G0х.р. > 0, но возможна реакция окисления оксида азота (2) кислородом, сопровождающаяся уменьшением энергии Гиббса ∆G0х.р.(2) < 0.
🎥 Видео
Решение задач на вычисление энергии Гиббса. 1 часть. 10 класс.Скачать

Свободная энергия Гиббса. 10 класс.Скачать

Внутренняя энергия и энтальпия. 10 класс.Скачать

Внутренняя энергия и энтальпия. Расчет энтальпии. Практическая часть. 10 класс.Скачать

Энергия Гиббса. Практическая часть. 10 класс.Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Что такое Энтропия?Скачать

Свободная энергия Гиббса и самопроизвольные реакции (видео 8) | Энергия| БиологияСкачать

Энтальпия реакции. Решение задачи.Скачать

2 4 Свободная энергия ГиббсаСкачать

Энтропия. 10 класс.Скачать

Решение задач на вычисление энергии Гиббса. 2 часть. 10 класс.Скачать
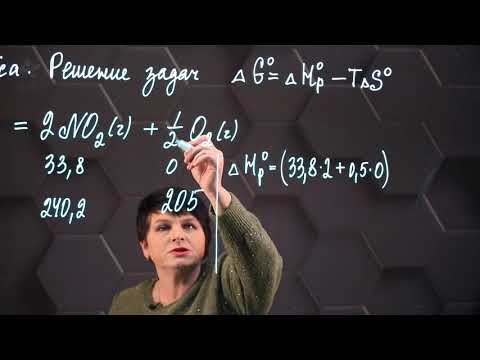
Закон Гесса. 10 класс.Скачать

2 1 Первый закон термодинамики ЭнтальпияСкачать

Термодинамика. Решение задач. Энтальпия, энтропия, энергия ГиббсаСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

ЭнтальпияСкачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

