Сравнительная характеристика атомов элементов подгруппы азота
Задача 878.
Дать сравнительную характеристику атомов элементов подгруппы азота, указав: а) электронные конфигурации; б) валентные возможности; в) наиболее характерные степени окисленности.
Решение:
а) Атомы элементов подгруппы азота имеют совпадающие по строению валентные подуровни (ns2np3) различные электронные остовы и вакантные подуровни. Два электрона валентных s-подуровней спарены, три электрона p-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р-подуровню. У фосфора есть один вакантный 3d-подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным.
б) Атом азота имеет два валентных 2s-электрона и три 2р-электрона, поэтому может проявлять степени окисления от -3 до +5 (-3, -2, -1, 0, +1, +2, +3, +4, +5). Фосфор, мышьяк, сурьма и висмут имеют одинаковую конфигурацию валентного уровня с атомом азота, но в возбуждённом состоянии их электрон с s-подуровня может занимать вакантную d-орбиталь [ns1hp3(n-1)d1]. Поэтому для этих элементов наиболее характерными степенями окисления являются -3, +3 (атомы находятся в стационарном состоянии) и +5 (атомы находятся в возбуждённом состоянии), исключением является фосфор, который может иметь степень окисления +1.
в) Имея три неспаренных р-электрона атомы элементов подгруппы азота в своём основном состоянии проявляют ковалентность равную 3, а в возбуждённом состоянии, кроме атома азота, ковалентность равную 5.
Задача 879.
Описать электронное строение NH3, NH4+, N2O, HNO3. Какова степень окисленности азота в каждом из этих соединений?
Решение:
а) Электронная конфигурация валентного слоя атома азота 1s22s22p3. Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
Три неспаренных электрона атома могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s1), имеющими по одному неспаренному электрону, с образованием молекулы NH3. Электронная формула аммиака имеет вид:
В молекуле аммиака азот имеет свободную электронную пару. Степень окисления азота -3.
б) Связывающая электронная пара атома азота способна с ионом водорода, имеющим свободную атомную орбиталь , образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония NH4+ из молекулы аммиака и иона водорода:
В результате образования донорно-акцепторной связи несвязывающая электронная пара атома азота становится связывающей, образуется четыре связи между одним атомом азота и четырьмя атомами водорода:
Все четыре связи равнозначны и по длине, и по энергии. Степень окисления азота +4.
в) Молекула N2O имеет электронное строение, которое рассматривается как резонансный гибрид двух асимметричных форм, обладающих линейной структурой:
Центральный атом азота имеет две sр-гибридные орбитали. Молекула N2О обладает небольшим дипольным моментом, поэтому оксид диазота умеренно растворим в воде. Степень окисления азота +1.
г) Молекула HNO3 с позиций метода валентных связей имеет следующее строение:
В молекуле HNO3 атом азота с одним атомом кислорода образует двойную связь за счет двух неспаренными электронов азота и кислорода, со вторым атомом кислорода азот образует одну связь за счет третьего неспаренного электрона азота и одного неспаренного электрона атома кислорода, а с третьим атомом кислорода азот образует связь за счет неподеленной электронной пары и свободной р-ячейки атома кислорода, образованной в результате объединения двух неспаренных электронов. Второй атом кислорода образует связь с атомом водорода за счет оставшегося неспаренного электрона и свободного электрона атома водорода. Однако современные методы исследования показали, что строение кислоты таково:
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи. Степень окисления азота +5.
💥 Видео
Элементы 15 (VA) группы. Азот. 9 класс.Скачать

Подгруппа азота. Общая характеристика элементов подгруппы азота. Неорганическая химия. Видеоурок #11Скачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Азот и фосфор VA группа | Химия ЕГЭ, ЦТСкачать

Общая характеристика элементов подгруппы азотаСкачать

Элементы подгруппы А I группы. Видеоурок по химии 9 классСкачать

Химия 9 класс: Группа азотаСкачать

Химия элементов VA группа Подгруппа азотаСкачать

Элементы пятой группы главной подгруппыСкачать
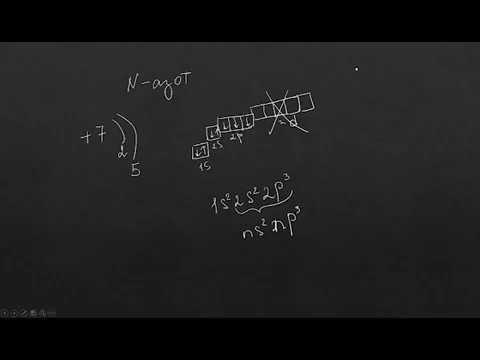
9 класс § 29 "Азот".Скачать

Элементы 16 (VIA) группы. 9 класс.Скачать

Особенности строения и свойства молекулы азота. 11 класс.Скачать

Подгруппа АзотаСкачать

255 Неорганическая химия Подгруппа азота Подгруппа азота Задача №1Скачать

Лекция Азот. Подгруппа Азота. ПниктогеныСкачать

Азот: химические свойства и особенности | Химия ОГЭ 2023 | УмскулСкачать

Элементы VA группы. АзотСкачать

257 Неорганическая химия Подгруппа азота Подгруппа азота Задача №3Скачать

284 Неорганическая химия Подгруппа азота Фосфор Задача №11Скачать

9 класс. Химия. Азот и его соединенияСкачать

