Вычисления по уравнению Фарадея | Электролиз
Решение задач на электролиз солей
Задание 265.
Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде? Ответ: 32,19 г; 1,67 л.
Решение:
Стандартный электродный потенциал системы Ag+ + = Ag0 (+0,80 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае на катоде будет происходить электрохимическое восстановление меди Ag+:
Ag+ + = Ag0
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 = О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал, характеризующий систему из кислородной кислоты. Ионы NO3—, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Массу выделившегося серебра находим из уравнения Фарадея, имея в виду, что 4 ч = 14400 с и МЭ(Ag) = 107,868 г/моль, получим:
m(Ag) = МЭ(В) . I . t/F = 107,868 . 2 . 14400/96500 = 32,19 г.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I. t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Поскольку при нормальных условиях эквивалентный объём кислорода равен 5,6 л/моль, получим:
V(О2) = (5,6 . 2 . 14400)/96500 = 1,67 л
Ответ: 32,19 г; V(О2) = 1,67 л.
Задание 266.
Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. Ответ, 32,7 г/моль.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно эквивалентной массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (5,49 . 96500)/(6 . 60 . 45) = 32,7 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: МЭ(Ме) = 32.7 г/моль.
Задание 267.
На сколько уменьшится масса серебряного анода, если электролиз раствора АgNO3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах. Ответ. 5,14 г.
Решение:
Массу уменьшения серебряного анода находим из уравнения Фарадея, имея в виду, что 38 мин 20 с = 2300 с и МЭ(Ag) = 107,868 г/моль, получим:
m(Ag) = МЭ(В) . I . t/F = 107,868 . 2 . 2300/96500 = 5,14 г.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Электронные уравнения процессов, происходящих на графитовых электродах при электролизе АgNO3.
Стандартный электродный потенциал системы: Ag+ + = Ag0 (+0,80 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае на катоде будет происходить электрохимическое восстановление меди Ag+:
Ag+ + = Ag0
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 = О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал, характеризующий систему из кислородной кислоты. Ионы NO3—, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
🔥 Видео
Закон Фарадея (теория + задача). Электролиз. Часть 4-1.Скачать

Электролиз. Закон Фарадея. 10 класс.Скачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Урок 298. Электрический ток в жидкостях. Закон Фарадея для электролизаСкачать

Электролиз. Задача на закон Фарадея с площадью поверхности и выходом по току.Скачать

Закон ФарадеяСкачать

Задачи на закон Фарадея. Средняя сложность. Электролиз. Часть 4-2.Скачать

Электролиз. Решение задач. 1 часть. 10 класс.Скачать

Электрический ток в жидкостях. Закон электролиза | Физика 10 класс #60 | ИнфоурокСкачать

ФИЗХА 10-11 класс | Электролиз, закон Фарадея | Олимпиадные задачи по химииСкачать

Электролиз. 10 класс.Скачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

ЭлектролизСкачать

Электролиз. Законы Фарадея. ЗадачиСкачать
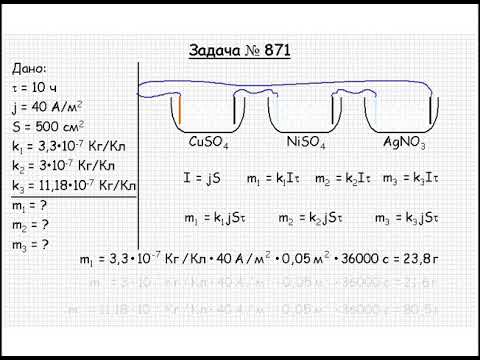
Химическое действие электрического тока. Закон Фарадея. Практическая часть. 8 класс.Скачать
Опыты по физике. Электролиз раствора сульфата меди (II). Первый закон ФарадеяСкачать

Закон Фарадея и плотность тока. Олимпиадная задача. Физика+химия.Скачать

Задача №34 на электролиз и протоны | ЕГЭ по химии 2024Скачать

Урок 186 (осн). Электрический ток в жидкостях. Закон Фарадея для электролизаСкачать

