Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
Видео:Эквивалент. Часть 1. Эквивалент элемента. Задачи.Скачать

Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
Видео:133. Эквивалент. Молярная масса эквивалента.Скачать

б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) — mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
Видео:Эквивалент и закон эквивалентовСкачать

Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение заменим равным ему отношением — объём водорода;
— эквивалентный объём водорода.
Тогда получим отношение
Находим эквивалентную массу оксида металла:
Согласно закону эквивалентов:
Ответ: 22,83г/моль; 14,83г/моль.
🌟 Видео
Что такое эквивалент?Скачать
Находим эквивалент вещества часть 1Скачать

Эквивалент. Часть 2. Эквивалент сложного в-ва: оксидов, оснований, кислот, солей.Скачать

Расчет молярной массы эквивалентовСкачать

Эквиваленты Закон эквивалентовСкачать

Химический эквивалентСкачать
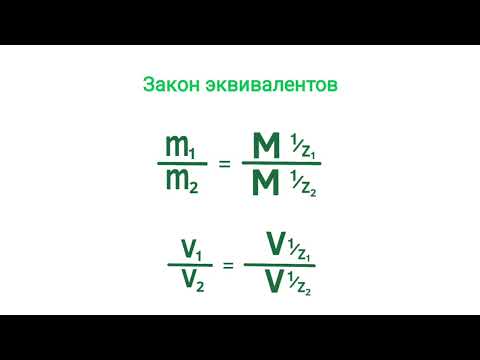
Экспериментальная часть лабораторной работы № 1 Определение молярной массы эквивалента металлаСкачать

Химический эквивалент и фактор эквивалентности в реакциях ионного обменаСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

ЭквивалентСкачать

ЭквивалентСкачать

Как применять закон эквивалентов в решении задачСкачать

Решение задач на эквивалентыСкачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

132. Фактор эквивалентности. Число эквивалентности.Скачать

Что такое нормальная концентрация?Скачать

Задачка на закон эквивалентовСкачать

