Задача 97.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество KCl, навеска массой 1,40 г; осадитель AgNO3, концентрация 10%.
Решение:
Схема реакции осаждения:
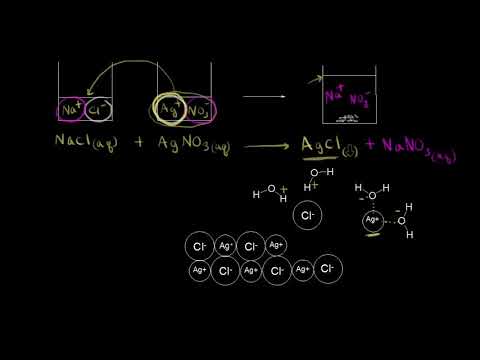
KCl + AgNO3 ⇔ AgCl↓ + KNO3
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2 или
n1(KCl) = n2(AgNO3).
где
Видео:Перекристаллизация, или очистка хлорида калия! [ChemistryToday]Скачать
![Перекристаллизация, или очистка хлорида калия! [ChemistryToday]](https://i.ytimg.com/vi/naxeGRmhnSI/0.jpg)
MЭ(KCl) = M(KCl) = 74,55 г/моль;
MЭ(AgCl) = M(AgCl) = 168,868 г/моль.
Согласно закону равенства эквивалентов:
Рассчитаем массу AgNO3:
М(AgNO3) = MЭ(AgNO3) . n(AgNO3) =
=74,55 . 0,0188 = 1,4 г.
Теперь рассчитаем объём раствора AgNO3, теоретически необходимый для осаждения 1,40 г KCl из пропорции:
Видео:Получение хлорида калия (synthesis of potassium chloride) KClСкачать

100 : 10 = х : 1,4;
х = (1,4 . 100)/10 = 14 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём
BaCl2 . 2H2O, необходимый для осаждения:
V(BaCl2 . 2H2O) = 1,5 . 14 = 21 см3.
Условия осаждения:
Определение осложняется тем, что AgCl склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- • медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- • повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Видео:химическая реакция взаимодействия хлорида калия с азотной кислотойСкачать

Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(AgNO3) = 21 см3.
Задача 98.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество KCl, навеска массой 1,50 г; осадитель AgNO3, концентрация 8%.
Решение:
Схема реакции осаждения:
KCl + AgNO3 ⇔ AgCl↓ + KNO3
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2 или
n1(KCl) = n2(AgNO3).
где
Видео:Взаимодействие хлорида железа III с роданидом калияСкачать

MЭ(KCl) = M(KCl) = 74,55 г/моль;
MЭ(AgCl) = M(AgCl) = 168,868 г/моль.
Согласно закону равенства эквивалентов:
Рассчитаем массу AgNO3:
М(AgNO3) = MЭ(AgNO3) . n(AgNO3) =
= 74,55 . 0,02 = 1,5 г.
Теперь рассчитаем объём раствора AgNO3, теоретически необходимый для осаждения 1,50 г KCl из пропорции:
Видео:Кристаллы из хлорида калияСкачать

100 : 8 = х : 1,5;
х = (1,5 . 100)/8 = 18,75 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём BaCl2 . 2H2O, необходимый для осаждения:
V(BaCl2 . 2H2O) = 1,5 . 18,75 = 28,125 см3.
Условия осаждения: Определение осложняется тем, что AgCl склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- • медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- • повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(AgNO3) = 28,125 см3.
💡 Видео
Определение концентрации вещества в растворе методом титриметрииСкачать

Электролиз раствора хлорида калия / electrolysis of potassium chloride solutionСкачать

Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Самая лучшая подборка реакций с хлоратом калия! (химия)Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Качественная реакция на ион трехвалентного железаСкачать

Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Уроки химии с БСК. Урок №2. Хлорид кальцияСкачать

Растворы и осадки (видео 1)| Произведение Растворимости | ХимияСкачать
🔥 ПОЛУЧЕНИЕ КАЛИЯ И НАТРИЯ В ДОМАШНИХ УСЛОВИЯХ своими рукамиСкачать

Роданит калия и хлорид железа |||Скачать

Синтез хлората калия или бертолетовой солиСкачать

Получение хлорида лития! Неорганический синтез вещества.Скачать

Перекристаллизация (Как очистить вещество?)Скачать

Приготовление раствора с заданной концентрациейСкачать

