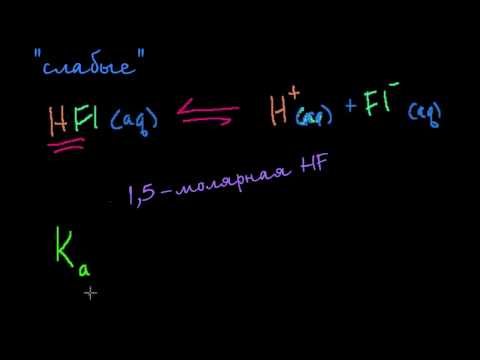Задача 139.
Рассчитайте рН 10% раствора аммония гидроксида (ρ = 0,958 г/мл).
Решение:
рК(NH4OH )= 4,76;
М(NH4OH) = 35,04 г/моль;
w% = 10% = 0,1;
pH = ?
1. Находим массу раствора, получим:
m(p-pa) = ρV = 0,958 г/мл • 1000 мл = 958 г.
Видео:pH и pOH сильных кислот и оснований (видео 5)| Кислоты и Основания | ХимияСкачать
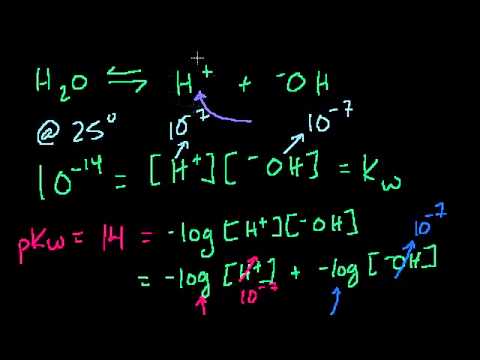
2. Расчет массы NH4OH в растворе, получим:
w% = m(B)•100%/m(p-pa), где
m(B) — масса растворенного вещества;
m(p-pa) — масса раствора.
m(B) = w%/m(p-pa)/100%;
m(NH4OH) = 10% * 958/100% = 95,8 г.
3. Рассчитаем концентрацию раствора аммония гидроксида, получим:
СМ(NH4OH) = m(NH4OH)/M(NH4OH) =
= 95,8 г/35,04 г/моль = 2,734 моль.
4. рН раствора аммония гидроксида проводим по формуле:
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

рН = 14 – 1/2(4,76- lg2,734) = 11,84.
Ответ: рН = 11,84.
Расчёт рН раствора серной кислоты
Задача 140.
Рассчитайте рН раствора серной кислоты с концентрацией 0,01 моль/л, если константы диссоциации ее по второй ступени Ка2 =1,02•10-2 моль/л.
Решение:
Уравнения ступеньчатой диссоциации кислоты:
H2SO4 = H(+) + HSO4(-);
HSO4(-) = H(+) + SO4(2-); Ка2 = 1,02•10-2.
Допустим, что на первой ступени кислота с концентрацией с моль/л образует с моль/л ионов H+ и с моль/л HSO4(-). Ионы HSO4(-) диссоциируя далее, дадут х моль/л ионов водорода и х моль/л ионов SO4(2-). Учитывая это, получим выражения для концентраций ионов в растворе кислоты, получим:
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

[H(+)] = (с + х);
[HSO4(-)] = (c — x);
[SO4(2-)] = х.
Тогда
Ка2 = {[H(+)][SO4(2-)]}/[HSO4(-)]
Следовательно
1,02•10-2 = [(c + x)•x]/(c — x), и при с = 10-2 моль/л;
1,02•10-2•(c — x) = cх + x2;
0,0102(0,01 — x) = 0,01х + x(2);
0,000102 — 0,0102х = 0,01х + x2;
x2 + 0,0202х — 0,000102 = 0, где
а — 1; b = 0,0202; с = -0,000102;
D = b2 — 4ac = (0,0202)2 — 4•1•(-0,000102) = 0,000408 — (-0.000408) = 0,00081604,
D > 0.
Видео:Расчет рН растворов сильных и слабых оснований. Химия для поступающих.Скачать

значит, решая уравнения, получим два значения х:
x1 = (-0,0202 + 0,0286)/(2•1) = 0,0042;
х2 = (-0,0202 — 0,0286)/(2•1) = -0.0244.
Примем за значение «х» положительное число, т.е. х = 0,0042.
Следовательно,
[H(+)] = (с + х) = 0,01 + 0,0042 = 0,0142 моль/л.
pH = -lg[H(+)] = -lg0,0142 = -lg1,42 . 10-2 =
= 2 — lg1,42 = 2 — 0,15 = 1,85.
Видео:pH и буферные растворы | Медицинская химия | МедвузаСкачать

Ответ: рН = 1,85.
Расчёт рН раствора соляной кислоты
Задача 141.
Вычислить значение рН раствора, полученного при сливании 50 мл 0,1 н HCl c 20 мл 0,1 н NaOH.
Дано:
Vк = 50 мл;
Vo = 20 мл;
Ск = 0,1 н;
Со = 0,1 н;
рН = ?
Решение:
1. Рассчитаем количество миллиэквивалентов взятых кислоты и основания (nк, nо, мэкв) до реакции, получим:
nк = Ск • V = 50•0,1 = 5 мэкв;
nо = Со • V = 20•0,1 = 2 мэкв.
2. Рассчитываем количество кислоты и основания после проведения реакции, получим:
Видео:Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])Скачать
![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)
nк = 5-2 = 3 мэкв;
nо = 0.
Таким образом, после проведения реакции в растворе останется сильная кислота HCl, которая будет определять рН раствора. Расчет ведут по формуле:
рН = — lg [H+] + [H+]ост =
= -lg[(Ск•Vк) – (Со•Vо)]/(Vk + Vo).
Тогда
рН = -lg(50•0,1) — (20•0,1)/(50 + 20) =
= -lg0,029 = 2 — 0,46 = 1,54.
Ответ: рН = 1,54.
Задачи на вычисление рН раствора:
1. рН раствора кислоты
2. рН раствора основания
3. рН раствора соли
🎦 Видео
Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])Скачать
![Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])](https://i.ytimg.com/vi/0qTq4bM0zHk/0.jpg)
Буферные растворы. 1 часть. 11 класс.Скачать

pH раствора солиСкачать

Слабые кислоты и основания. рНСкачать

Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать

Определение рН потенциометрическим методомСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Расчет pH растворов сильных кислот и оснований | Аналитическая химияСкачать
Лабораторный опыт №1 «Определение рН растворов кислот, щелочей» 9 классСкачать

рН слабых кислотСкачать