Типы гибридизации АО. Полярность молекул. Геометрическая структура молекул
Задача 261.
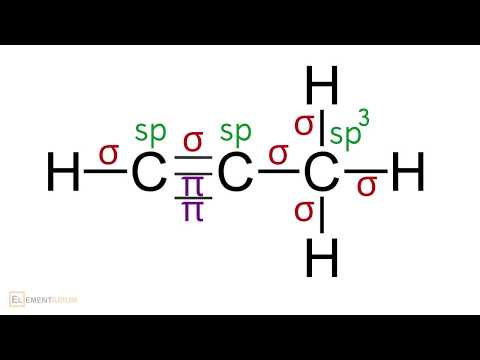
Какие типы гибридизации АО углерода соответствуют образованию молекул СН4, С2Н6, С2Н4, С2Н2?
Решение:
а) В молекулах СН4 и С2Н6 валентный электронный слой атома углерода содержит четыре электронных пары:
Поэтому электронные облака атома углерода в молекулах СН4, С2Н6 будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При этом в молекуле СН4 все вершины тетраэдра будут заняты атомами водорода, так что молекула СН4 имеет тетраэдрическую конфигурацию с атомом углерода в центре тетраэдра. В молекуле С2Н6 атомы водорода занимают три вершины тетраэдра, а к четвёртой вершине направлено общее электронное облако другого атома углерода, т.е. два атома углерода соединены друг с другом. Это можно представить схемами:
б) В молекуле С2Н4 валентный электронный слой атома углерода, как и в молекулах СН4, С2Н6. содержит четыре электронные пары:
При образовании С2Н4 три ковалентные связи образованы по обычному механизму, т.е. являются — связями, и одна — — связь. При образовании молекулы С2Н4 каждый атом углерода с двумя атомами водорода — связями и друг с другом двумя связями, одной — и одной — связями. Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме углерода так, чтобы взаимодействие между электронами было минимальным, т.е. как можно дальше друг от друга. Данное расположение атомов углерода (две двойные связи между атомами углерода) характерно для sp2-гибридизации АО углерода. При sp2-гибридизации электронные облака в атомах углерода ориентированы в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. в направлениях к вершинам правильного треугольника. В молекуле этилена в образовании — связей участвуют три sp2-гибридные орбитали каждого атома углерода, две между двумя атомами водорода и одна со вторым атомом углерода, а — связь образуется за счёт р-электронных облаков каждого атома углерода. Структурная формула молекулы С2Н4 будет иметь вид:
в) В молекуле С2Н2 валентный электронный слой атома углерода содержит четыре пары электронов:
Структурная формула С2N2 имеет вид:
Каждый атом углерода соединён одной электронной парой с атомом водорода и тремя электронными парами с другим атомом углерода. Таким образом, в молекуле ацетилена атомы углерода соединены друг с другом одной -связью и двум -связями. С водородом каждый атом углерода соединён -связью. В образовании — связей участвуют две sp-гибридные АО, которые расположены друг относительно друга так, что взаимодействие между ними минимальное, т.е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака между атомами углерода ориентированы в противоположных направлениях друг относительно друга, т.е. угол между связями С—С составляет 1800. Поэтому молекула С2Н2 имеет линейное строение:
Задача 262.
Указать тип гибридизации АО кремния в молекулах SiH4 и SiF4. Полярны ли эти молекулы?
Решение:
В молекулах SiH4 и SiF4 валентный электронный слой содержит четыре пары электронов:
Поэтому в обоих случаях электронные облака атома кремния будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При этом в молекуле SiH4 все вершины тетраэдра заняты атомами водорода, а в молекуле SiF4 – атомами фтора, так что эти молекулы имеют тетраэдрическую конфигурацию с атомом кремния в центре тетраэдра:
В тетраэдрических молекулах SiH4 и SiF4 дипольные моменты связей Si—H и Si—F взаимно компенсируют друг друга, так что суммарные дипольные моменты обоих молекул будут равны нулю. Эти молекулы неполярны, несмотря на полярность связей Si—H и Si—F.
Задача 263.
В молекулах SО2 и SО3 атом серы находится в состоянии sp2-гибридизации. Полярны ли эти молекулы? Какова их пространственная структура?
Решение:
При sp2-гибридизации гибридные облака располагаются в атоме серы в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. направленных к вершинам правильного треугольника.
а) В молекуле SО2 две sp2-гибридные АО образуют связь с двумя атомами кислорода, третья sp2-гибридная орбиталь будет занята свободной электронной парой. Эта электронная пара будет смещать электронную плоскость и молекула SО2 примет форму неправильного треугольника, т.е. угол OSO не будет равен 1200. Поэтому молекула SО2 будет иметь угловую форму при sp2-гибридизации орбиталей атома структуру:
В молекуле SО2 взаимной компенсации дипольных моментов связей S—O не происходит; дипольный момент такой молекулы будет иметь значение больше нуля, т.е. молекула полярна.
б) В угловой молекуле SО3 все три sp2-гибридные АО образуют связь с тремя атомами кислорода.Длина связи S – O равна 0,142 нм, валентный угол составляет 120°. Молекула SО3 будет иметь форму плоского треугольника с sp2-гибридизацией атома серы:
В треугольной молекуле SО3 дипольные моменты связей S—O взаимно компенсируют друг друга, так что суммарный дипольный момент будет равен нулю, молекула неполярна.
Задача 264.
При взаимодействии SiF4 с HF образуется сильная кислота Н2SiF6, диссоциирующая на ионы Н+ и SiF62-. Может ли подобным образом протекать реакция между СF4 и НF? Указать тип гибридизации АО кремния в ионе SiF62-.
Решение:
а) При возбуждении атом кремния переходит из состояния 1s22s22p63s23p2 в состояние 1s22s22p63s13p33d0, а электронное строение валентных орбиталей соответствует схеме:
Четыре неспаренных электрона возбуждённого атома кремния могут участвовать в образовании четырёх ковалентных связей по обычному механизму с атомами фтора (1s22s22p5), имеющими по одному неспаренному электрону с образованием молекулы SiF4.
При взаимодействии SiF4 с HF образуется кислота Н2SiF6. Это возможно, потому что в молекуле SiF4 имеются свободные 3d-орбитали, а в ионе F- (1s22s22p6) свободные пары электронов. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов каждого из двух ионов F— (HF ↔ H+ + F—) и свободных 3d-орбиталей молекулы SiF4. При этом образуется ион SiF62-, который с ионами H+ образует молекулу кислоты Н2SiF6.
б) Углерод (1s22s22p2) может образовать, подобно кремнию, соединение СF4, но при этом валентные возможности атома углерода будут исчерпаны (нет неспаренных электронов, свободных пар электронов и свободных валентных орбиталей на валентном уровне). Схема строения валентных орбиталей возбуждённого атома углерода имеет вид:
При образовании СF4 все валентные орбитали углерода заняты, поэтому ион образоваться не может.
В молекуле SiF4 валентный электронный слой атома кремния содержит четыре пары электронов:
Это же наблюдается и для молекулы СF4. поэтому в обоих случаях электронные облака атомов кремния и углерода будут максимально удалены друг от друга при sp3-гибридизации. Когда их оси будут направлены к вершинам тетраэдра:
🎬 Видео
Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

Лайфхак по определению гибридизации за 7 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

ХИМИЮ УЧИТЬ ЛЕГКО! ГибридизацияСкачать

Типы гибридизации атома углерода | Химия ЕГЭ 10 класс | УмскулСкачать

Все про гибридизацию на ЕГЭ по химии | УмскулСкачать

Органика. Виды гибридизации орбиталей (sp-, sp2-, sp3-гибридизация)Скачать

Гибридизация атома углерода | Химия ЕГЭ для 10 класса | УмскулСкачать

1. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ (ЧАСТЬ 1)Скачать

Гибридизация для школьников, валентные состояния атома углерода (sp, sp², sp³)Скачать

Химия. 10 класс. Гибридизация атомных орбиталей. Геометрия молекул /07.10.2020/Скачать

Гибридизация. Виды гибридизации. Теория для задания 12 ЕГЭ по химии.Скачать
Теория гибридизации (Russian)Скачать
ЛЕКЦИЯ 1.1. ГИБРИДИЗАЦИЯ, СОПРЯЖЕНИЕ, АРОМАТИЧНОСТЬСкачать

Движение электронов в атоме. 1 часть. 8 класс.Скачать

4. sp sp2 sp3 гибридизация, как определить?Скачать
Химия | Гибридизация. Алгоритм определения гибридизацииСкачать

2. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ (ЧАСТЬ 2)Скачать

Типы гибридизации 2Скачать

Определяем типы гибридизацииСкачать

