Составление формулы мицеллы золя и рассчет порога коагуляции электролита
Изменение порога коагуляции электролита
Задача 72.
Как изменится порог коагуляции электролита для золя бромида серебра, частицы которого заряжены положительно, если для коагуляции 0,1 л золя вместо 0,0015 л 0,1 н K2SO4 взят раствор Fe(NO3)3.
Решение:
Vэл = 0,0015 л;
Vз = 0,1 л;
CM(K2SO4) = 0,1 н;
CM[Fe(NO3)3] = 0,1 н;
∆ПК = ?
Минимальное количество электролита, прибавляемого к золю, которое вызывает коагуляцию, называется порогом коагуляции (ПК, ммоль/л). Порог коагуляции можно рассчитать по формуле:
ПК = (СЭ .Vэл)/(Vэл + Vз), где
СЭ – эквивалентная концентрация (молярная концентрация эквивалента), моль/л;
Vэл. – объемы электролита, мл;
Vз. – золя соответственно, мл.
СЭ(K2SO4) = CM(K2SO4) . 2 = 0,1 . 2 = 0,2 моль/л;
СЭ[Fe(NO3)3] = CM[Fe(NO3)3] . 3 = 0,1 . 3 = 0,3 моль/л.
В нашем случае электролитами-коагулянтами являются растворы K2SO4 и Fe(NO3)3. Согласно правилу Шульце — Гарди (правило значности), при коагуляции золя электролитами коагулирующий ион имеет заряд, противоположный заряду коллоидной частицы; а порог коагуляции при этом тем меньше, чем выше заряд коагулирующего иона. В нашем случае
ионами-коагулянтами выступают анионы SO42- и NO3—.
Вычисляем пороги коагуляции добавляемых электролитов:
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

ПК(SO42-) = (0,2 моль/л . 0,0015 л)/(0,1 л + 0,0015 л) = 0,00296 моль/л или 2,96 ммоль/л;
ПК(NO3—) = ((0,3 моль/л . 0,0015 л)/(0,1 л + 0,0015 л) = 0,00443 моль/л или 4,43 ммоль/л.
∆ПК = ПК(NO3—) — ПК(SO42-) = 4,43 ммоль/л — 2,96 ммоль/л = 1,47 ммоль/л.
Так как 2,96 ммоль/л < 4,43 ммоль/л = ПК(SO42-) < ПК(NO3—), то порог коагуляции увеличится с применением раствора Fe(NO3)3 на 1,47 ммоль/л.
Задача 73.
Какой из этих электролитов-коагуляторов будет обладать меньшим порогом коагуляции: K3PO4, (CHCOO)2Zn, AlCl3?
Решение:
Порог коагуляции — это минимальная концентрация электролита, которая вызывает явную коагуляцию коллоидного раствора (помутнение раствора или изменение его окраски). Чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
Надо знать правило Шульце — Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный
заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора (правило значности). Следовательно, наименьший порог коагуляции (или наибольшая коагулирующая способность) у иона с большим зарядом по отношению к иону с меньшим зарядом, т.е. коагулирующая способность трёхзарядного иона выше коагулирующей способности двухзарядного иона и тем более однозарядного.
Правило Шульце-Гарди на основании опытных данных дает для 1-, 2- и 3-зарядных противоионов соотношение (ряд Шульце-Гарди):
1 : 0,04 : 0.002 = 1 : 1/25 : 1/500.
Значения порогов коагуляции электролитов с одно-, двух- и трехзарядными ионами относятся как числа:
729 : 11 : 1
Согласно правилу Шульца-Гарди, теоретически обоснованному Дерягиным и Ландау, порог коагуляции обратно пропорционален заряду противоиона в шестой степени.
Коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора (правило значности). Следовательно, наименьший порог коагуляции (или наибольшая коагулирующая способность) у иона с большим зарядом по отношению к иону с меньшим зарядом, т.е. коагулирующая способность трёхзарядного иона выше коагулирующей способности двухзарядного иона и тем более однозарядного.
Поскольку в электролитах K3PO4, (CHCOO)2Zn, AlCl3 заряд катионов в ряду наибольший у Al3+, то AlCl3 будет обладать наименьшим порогом коагуляции в случае если потенциалопределяющими ионами будут катионы (электролит взят в избытке). Если же потенциалопределяющими ионами будут являться анионы, то наименьшим порогом коагуляции будет являться K3PO4, так как электролит содержит 3-зарядный ион PO43- — электролит взят в недостатке.
Составление формулы мицеллы золя
Задача 74.
Золь бромида свинца (ΙΙ) получен реакцией бромида кальция с избытком ацетата свинца (ΙΙ). Написать формулу мицеллы.
Решение:
Золь получен по следующему уравнению реакции:
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 2Скачать
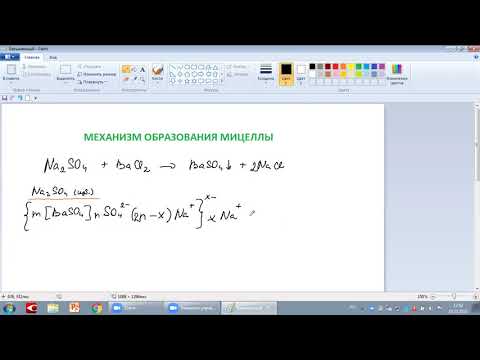
Pb(CH3COO)2 + CaBr2 ⇔ PbBr2↓ + Ca(CH3COO)2,
из которого следует, что агрегатом является малорастворимый бромид свинца PbBr2.
Диссоциация вещества, взятого в избытке:
Pb(CH3COO)2 = Pb2+ + 2CH3COO–
Pb2+-противоион(ПИ). Так как в избытке Pb(CH3COO)2, значит, ядром коллоидных частиц будут адсорбироваться Pb2+ и частицы золя приобретут положительный заряд. Противоионами будут служить ионы Br–.
Формула мицеллы золя будет выглядеть следующим образом:
{[m(PbBr2)]·nPb2+, 2(n-x)Br–]}2x+·2xBr–, где
mPbBr2 -зародыш — нерастворимое вещество, образовавееся в ходе реакции;
m-коэффициент, указывающий число частиц вещества;
nPb2+ — потенциалопределяющие ионы, адсорбирующие на зародыше. Они составляют ядро мицеллы —
Видео:Схема строения мицеллыСкачать

[m(PbBr2)]·nPb2+;
часть противоионов адсорбируется непосредственно на ядре и оставляет адсорбиционный слой противоионов, его обозначают в данном случае —
2(n-x)Br–;
ядро с адсорбиционным слоем противоионов составляет гранулу мицеллы —
{[m(PbBr2)]·nPb2+, 2(n-x)Br–]};
гранула имеет заряд, знак которого определяется знаком заряда потенциалопределяющих ионов, в данном случае «2х+» —
{[m(PbBr2)]·nPb2+, 2(n-x)Br–]}2x+;
заряд гранулы нейтрализуется противоионами диффузного слоя, число которых составляет 2xBr–.
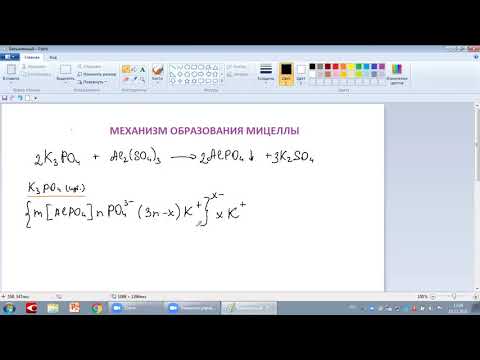
Задача 75.
Написать формулу мицеллы, полученной при взаимодействии хлорида цинка с избытком гидроксида натрия. Указать составляющие мицеллы. К какому электроду будет двигаться гранула в электрическом поле?
Решение:
Запишем уравнение реакции, протекающей при сливании двух растворов:
2NaOH + ZnCl2 = Zn(OH)2↓ + 2NaCl,
из которого следует, что агрегатом является малорастворимый гидроксид цинка Zn(OH)2.
Видео:МицеллаСкачать

Диссоциация вещества, взятого в избытке:
NaOH = Na+ + OH–
Так как в избытке NaOH, значит, ядром коллоидных частиц будут адсорбироваться OH– (потенциалопределяющие ионы, входящие в его состав и находящиеся в растворе в избытке) и частицы золя приобретут отрицательный заряд. Потенциалопределяющие ионы — ионы, входящие в состав зародыша [Zn(OH)2] и находящиеся в растворе в избытке, у нас ионы OH–.
Противоионами будут служить ионы Na+ (противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой). Противоионы — ионы, содержащиеся в растворе, но не входящие в состав агрегата, у нас ионы Na+
Формула мицеллы золя будет выглядеть следующим образом:
{[Zn(OH)2)m]·nOH–, (n-x)Na+]}x–·xNa+, где
Zn(OH)2 -зародыш (агрегат) — нерастворимое вещество, образовавееся в ходе реакции;
m — коэффициент, указывающий число частиц вещества;
nOH– — потенциалопределяющие ионы, адсорбирующие на зародыше. Они составляют ядро мицеллы:
Zn(OH)2)m]·nOH–;
часть противоионов адсорбируется непосредственно на ядре и оставляет адсорбиционный слой противоионов, его обозначают в данном случае (n-x)Na+;
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 4Скачать
ядро с адсорбиционным слоем противоионов составляет гранулу мицеллы —
{[Zn(OH)2)m]·nOH–, (n-x)Na+]};
гранула мицеллы имеет заряд, знак которого определяется знаком заряда потенциалопределяющих ионов, в данном случае «x-» —
{[Zn(OH)2)m]·nOH–, (n-x)Na+]}x-;
заряд гранулы нейтрализуется противоионами диффузного слоя, число которых составляет xNa+.
Так как гранула мицеллы имеет отрицательный заряд, то она будет двигаться к положительно заряженному электроду — аноду.
Задача 76.
Написать мицеллу образовавшегося золя Mg(OH)2, полученной при взаимодействии хлорида магния с гидроксида натрия, если хлорид магния взят в избытке.
Решение:
Реакция будет иметь вид:
MgCl2(избыток) + 2NaOH = Mg(OH)2 + 2NaCl.
Из уравнения реакции следует, что ядром коллоидной частицы является малорастворимый гидроксид магния Mg(OH)2.
Диссоциация вещества, взятого в избытке:
MgCl2 = Mg2+ + 2Cl–.
Так как в избытке MgCl2, значит, агрегатом коллоидных частиц будут адсорбироваться Mg2+ (потенциалопределяющие ионы, входящие в его состав и находящиеся в растворе в избытке) и частицы золя приобретут положительный заряд. Потенциалопределяющие ионы — ионы, входящие в состав зародыша (Mg(OH)2) и находящиеся в растворе в избытке, у нас ионы Mg2+.
Противоионами будут служить ионы Cl– (противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой). Противоионы — ионы, содержащиеся в растворе, но не входящие в состав агрегата, у нас ионы Cl–.
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 3Скачать

Формула мицеллы золя будет выглядеть следующим образом:
{[Mg(OH)2m]·nMg2+, 2(n-x)Cl–]}2x+·2xCl–
🔍 Видео
Мицелла. Агрегат - BaSO4. Стабилизатор - Na2SO4Скачать

Золи. Лиофобные коллоидные системыСкачать
#72 Номер 72 из Демидовича | Число eСкачать

Мицелла. Агрегат – Cu(OH)2. Стабилизатор – CuSO4.Скачать

Задача на нахождение части от числа. Как решать задачи с дробями?Скачать

Правило Шульце ГардиСкачать
Теорема Монжа + задача 76Скачать

Логарифмическая линейка Извлекаем корниСкачать

5.4. Мицеллообразование в растворах ПАВ. Критическая концентрация мицелообразованияСкачать

Решение задач на индуктивный и мезомерный эффекты в молекулах. Часть 1.Скачать

#76 Номер 76 из Демидовича | Число eСкачать

Лекция 5.7. Ортогонализация Грама-Шмидта: примерСкачать

6.1 Численные методы решения задачи Коши для ОДУСкачать
Математика ЕГЭ 2024 профиль. Задание 9. Задачи с прикладным содержаниемСкачать

