Как образуются и каково строение коллоидных частиц
Золь гидроксида железа
Задача 136.
Почему золь гидроксида железа, полученный при гидролизе FeCl3, имеет вид прозрачного плотного чая, а этот же золь, полученный пептизацией, значительно светлее и немного каламутный?
Решение:
1. Получение золя гидроксида железа (III) при гидролизе
Золь гидроксида трехвалентного железа получают гидролизом хлорида железа(III). Гидролиз соли FeCl3 происходит по стадиям, причем скорость и степень гидролиза возрастают при повышении температуры и увеличении разведения:
FeCl3 + H2O ↔ FeOHCl2 + HCl (1)
FeOHCl2 + H2O ↔ Fe(OH)2Cl + HCl (2)
Fe(OH)2Cl + H2O ↔ Fe(OH)3 + HCl. (3)
Так как на каждой ступени гидролиза выделяется HCl, то равновесие на последней стадии сдвинуто влево, т.е. гидролиз не протекает до конца и в системе присутствуют как Fe(OH)3, так и Fe(OH)2Cl. Дигидрохлорид железа (III) при нагревании подвергается дегидратации:
Fe(OH)2Cl ↔ FeOCl + H2O (4)
Образующаяся соль FeOCl играет роль стабилизатора.
Уравнение реакции в общем виде:
FеСl3 + 3Н2О = Fе(ОН)3 + 3НСl
Так как на каждой ступени гидролиза выделяется HCl, то равновесие на последней стадии сдвинуто влево, т.е. гидролиз не протекает до конца и в
системе присутствуют как Fe(OH)3, так и Fe(OH)2Cl. Дигидрохлорид железа(III) при нагревании подвергается дегидратации:
Видео:Схема строения мицеллыСкачать

Fe(OH)2Cl ↔ FeOCl + H2O
Образующаяся соль FeOCl играет роль стабилизатора.
Элементарная частица золя называется мицеллой.
В результате гидролиза FeCl3 образуется красно-коричневый золь гидроксида железа(III). Строение мицеллы полученного золя можно изобразить следующим образом:
{m[Fe(OH)3]·nFeO+ · (n-x)Cl–}x+ · xCl–, где
m[Fe(OH)3] — агрегат; [Fe(OH)3]m · nFeO+ — ядро; {m[Fe(OH)3]·nFeO+ · (n-x)Cl–}x+ – коллоидная частица (гранула); nFeO+ · (n-x)Cl– — адсорбционный слой;
xCl– — диффузный слой; FeO+ — противоион; (n-x)Cl– противоионы адсорбционного слоя; xCl– — противоионы диффузного слоя.
2. Получение гидрозоля гидроксида железа (III) методом пептизации
Сначала приготовливается осадок гидроксида железа (III) по реакции FeCl3 и концентрированного раствора NH4OH. При этом образуется осадок гидроксида железа по уравнению:
FeCl3 + NH4OH = Fe(OH)3 + 3NH4Cl
Полученный осадок Fe(OH)3 отмывают от хлорида аммония и избытка аммиака дистиллированной водой. К промытому осадку приливают примерно 100 мл дистиллированной воды.
Далее к взмученному в дистиллированной воде осадку Fe(OH)3, в качестве пептизатора, вливают 2%-ный раствор FeCl3. Содержимое тщательно перемешивают и нагревают. При этом осадок Fe(OH)3 переходит в раствор, образуя высокодисперсный золь гидроксида железа.
Пептизатором осадка служит оксихлорид железа, образующийся в результате реакции:
FeCl3 + H2O ↔ FeOCl + 2HCl
Молекулы FeOCl в растворе диссоциируют на ионы FeO+ и Cl–. Ионы FeO+, адсорбируясь на частицах Fe(OH3), сообщают им положительный заряд. Получается вишнево-красный золь Fe(OH)3. Нужно иметь, что гидролиз насыщенного раствора FeCl3 практически не идет.
Схема строения мицеллы образующегося гидрозоля гидроксида железа такая же, как и при гидролизе соли FeCl3:
{m[Fe(OH)3]·nFeO+ · (n-x)Cl–}x+ · xCl–
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Таким образом, золь гидроксида железа, полученный при гидролизе FeCl3, имеет вид прозрачного плотного чая (красно-коричневый), а тот же золь, но олученный пептизацией, значительно светлее (вишнево-красный) и немного каламутный. Это объясняется тем, что гидролизный золь, за счет присутствия в растворе примесей от гидролиза соли FeCl3 имеет более окрашенный коллоидный раствор, а тот же золь, но полученный методом пептизации, коллоидный раствор содержит меньше примесей за счет отсутствия гидролиза соли FeCl3.
1. химизм получения золя методом гидролиза:
FeCl3 + H2O ↔ FeOHCl2 + HCl (1)
FeOHCl2 + H2O ↔ Fe(OH)2Cl + HCl (2)
Fe(OH)2Cl + H2O ↔ Fe(OH)3 + HCl. (3)
Fe(OH)2Cl ↔ FeOCl + H2O. (4)
Уравнение реакции в общем виде:
FеСl3 + 3Н2О = Fе(ОН)3 + 3НСl.
2. Метод пептизации:
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 2Скачать
FeCl3 + NH4OH = Fe(OH)3 + 3NH4Cl
FeCl3 + H2O ↔ FeOCl + 2HCl
Схема строения мицеллы образующегося гидрозоля гидроксида железа такая же, как и при гидролизе соли FeCl3 и при пептизации:
{m[Fe(OH)3]·nFeO+ · (n-x)Cl–}x+ · xCl–
Формула и строение мицеллы карбоната кальция
Задача 137.
Какова формула и схема строения мицеллы, полученной при действии избытка Na2CO3 на CaCl2?
Решение:
Составление формулы мицеллы, полученной при взаимодействии хлорида кальция с избытком карбоната натрия:
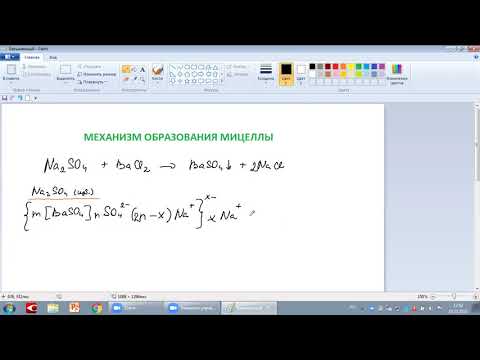
CaCl2 + Na2CO3(изб) = CaCO3 + 2NaCl
mCaCO3 -зародыш(агрегат) — нерастворимое вещество, образовавееся в ходе реакции, где
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 4Скачать
m-коэффициент, указывающий число частиц вещества.
CaCl2-противоион(ПИ)
Диссоциация вещества, взятого в избытке:
Na2CO3 = 2Na+ + CO32–
n CO32– — потенциалопределяющие ионы, адсорбирующие на зародыше. Они составляют агрегат мицеллы [mCaCO3]·n CO32–.
Часть противоионов адсорбируется непосредственно на ядре и оставляет адсорбиционный слой противоионов, его обозначают в данном случае 2(n-x)Na+.
Ядро с с адсорбиционным слоем противоионов составляет гранулу мицеллы —
{[mCaCO3]·n CO32– · 2(n-x)Na+}.
Гранула имеет заряд, знак которого определяется знаком заряда потенциалопределяющих ионов, в данном случае «2х-» —
[mCaCO3]·n CO32– · 2(n-x)Na+}2х–.
Заряд гранулы нейтрализуется противоионами диффузного слоя, число которых составляет 2хNa+.
Схема строения мицеллы золя CacO3, полученного в избытке Na2CO3
Видео:Урок 142. Простейшие задачи на вычисление числа и массы молекулСкачать

Катионы Са2+ будут связаны в агломерат (зародыш) и никак не могут быть противоионами для гранулы.
А вот катионов натрия Na+ в растворе «море».
Поэтому мицелла будет иметь вид:
[mCaCO3]·n CO32– · 2(n-x)Na+}2х–· xNa+.
Строение мицеллы фосфата меди
Задача 138.
Составить из ядра формулу, а потом из формулы мицеллу. Ядро — Cu3(PО4)2.
Решение:
Получение гидрозоля Cu3(PО4)2 возможно при реакции:
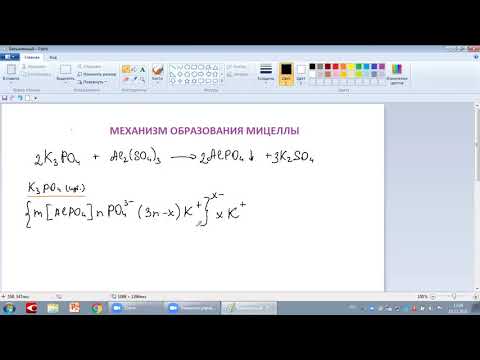
3CuCl2 + 2Na3PO4 = Cu3(PO4)2 + 6NaCl
Такое ядро могут иметь 3 разных мицеллы.
Рассмотрим случай, если в избытке Na3PO4, значит, в качестве потенциалопределяющих ионов, т.е. ионов, входящих в его состав и находящиеся в растворе в избытке, выступают PO43–.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Na+.
Формула мицеллы золя будет выглядеть следующим образом:
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 3Скачать

{m[Cu3(PO4)2]·nPO43– · 3(n-x)Na+]3x–·3xNa+
Из чего следует:
m[Cu3(PO4)2] — ядро мицеллы;
m[Cu3(PO4)2]·nPO43– — агрегат (плюс потенциалопределяющие ионы);
{m[Cu3(PO4)2]·nPO43– · 3(n-x)Na+]3x– — гранула.
3(n-x)Na+ — адбсорбционный слой ионов;
3xNa+ — диффузионный слой ионов.
🔍 Видео
МицеллаСкачать

решение задач на примесиСкачать

Задача недели. Химия. №43. Законы РауляСкачать

Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Задача на расчет молярной концентрации (См) по схемам ОВР + титрование.Скачать

Молярная концентрация. 10 класс.Скачать

Влияние температуры на скорость химических реакций. Практическая часть. 10 класс.Скачать

Урок 153 (осн). Вычисление сопротивления проводника. Удельное сопротивлениеСкачать

Задача А. ДезинфекцияСкачать

Лекция 6.2 | Пример решения задачи по панельному методу | Потенциальные течения жидкостиСкачать

Дифференциальные уравнения 13. Изопериметрические задачиСкачать

Генетика за час! Законы Менделя, решение генетических задач. Подготовка к ЕГЭ по биологии. Часть 1Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

