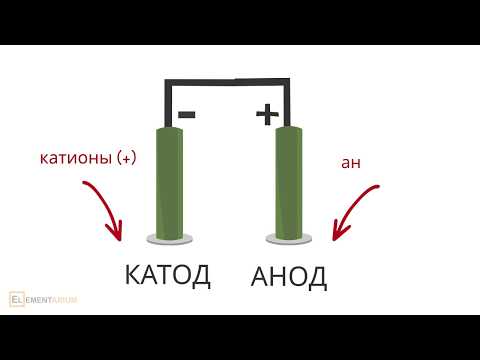
Схема электролиза водного раствора соли
Задача 590.
Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
Решение:
ZnCl2 ⇔ Zn2+ + 2Cl—
Стандартный электродный потенциал системы Zn2+ + 2 = Zn0 (-0,76 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением газообразного водорода:
2H2O + 2 ⇔ H2↑ + 2ОH—
а ионы цинка Zn2+, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе Zn0 + 2 ⇔ Zn2+ (-0,76 В) значительно ниже 2Cl— — 2 ⇔ Cl2 (+1,36 В). Ионы хлора, движущиеся к аноду, будут накапливаться в анодном пространстве. Таким образом, на аноде будет происходить растворение цинка — материал анода, а на катоде – выделение газообразного водорода. В анодном пространстае будет накапливаться хлорид цинка, а в катодном пространстве ионы цинка, соединяясь с гидроксид-ионами, образуют малорастворимое соединение Zn(OH)2.
Уравнения электродных процессов:
А(+): Zn0 — 2e ⇔ Zn2+
К(-): 2H2O + 2 ⇔ H2↑ + 2ОH—
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Zn0 ⇔ H2↑ + 2OH- + Zn2+
катод анод
Таким образом, при электролизе ZnCl2 с цинковым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк) и будут накапливаться ионы цинка и хлорид-ионы.
б) При электролизе ZnCl2 с угольным анодом будут происходить следующие процессы:
на катоде: 2H2O + 2 ⇔ H2↑ + 2ОH—;
на аноде: 2Cl— — 2 ⇔ Cl2,
хотя стандартные электродные потенциалы системы 2H2O — 4 ⇔ O2↑ + 4Н+ и 2Cl— — 2 ⇔ Cl2, соответственно, равны 1,23В и 1,36В. Объясняется это тем, что происходит перенапряжение системы на аноде.
Таким образом, при электролизе раствора хлорида цинка с угольным электродом на катоде будет будет наблюдаться выделение газообразного водорода и в катодном пространстве будет выпадать осадок гидроксида цинка, а на аноде будет наблюдаться выделение газообразного хлора.
Задача 691.
Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
Решение:
CaSO4 ⇔ Ca2+ + SO42-
Стандартный электродный потенциал системы Cu2+ + 2 ⇔ Cu0 (+0,34 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Cu2+ + 2 ⇔ Cu0
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе Cu2+ — 2 ⇔ Cu (+0,34В) значительно ниже 2SO42- + 2 ⇔ S2O82- (+2,01В). Ионы SO42-, движущиеся к аноду, будут накапливаться в анодном пространстве. Таким образом, на аноде будет происходить растворение меди — материал анода, а на катоде – выделение газообразного водорода. В анодном пространстае будет накапливаться сульфат меди, а в катодном пространстве ионы меди, соединяясь с гидроксид-ионами, образуют малорастворимое соединение Cu(OH)2.
Уравнения электродных процессов:
А(+): Cu0 — 2e ⇔ Cu2+
К(-): Cu2+ + 2e ⇔ Cu0
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu0 + Cu2+ = Cu2+ + Cu0
анод катод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид меди, на аноде будет происходить растворение материала анода (медь) и будут накапливаться ионы меди и сульфат-ионы.
б) При электролизе CuSO4 с угольным анодом будут происходить следующие процессы (стандартный электродный потенциал системы 2H2O — 4 ⇔ O2↑ + 4OH— и 2SO42- + 2 ⇔ S2O82-, соответственно, равны 1,23 В и 2,01 В):
на катоде: 2|4|Cu2+ + 2 ⇔ Cu0
на аноде: 1|2|2H2O — 4 ⇔ O2↑ + 4Н+.
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + 2Cu2+ ⇔ О2↑ + 4Н+ + 2Cu (ионно-молекулярная форма);
анод катод
2CuSO4 + 2H2O → 2H2SO4 + O2↑ + 2Cu (молекулярная форма).
Таким образом, при электролизе раствора сульфата меди с угольным анодом на аноде будет наблюдаться выделение газообразного кислорода, и в анодном же пространстве будет накапливаться сульфат-ионы, которые с ионами водорода создают кислую среду, будет накапливаться серная кислота (2H+ + SO42- = H2SO4); на катоде будет откладываться металлическая медь.
🔥 Видео
Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химииСкачать
Электролиз. 10 класс.Скачать

Схема электролиза водного раствора AgNO3Скачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Схема электролиза водного раствора NaClСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз растворов. 2 часть. 10 класс.Скачать

ЭлектролизСкачать

Электролиз расплавов и растворов. 10 класс.Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Электролиз расплавов и растворов. 1 часть. 10 класс.Скачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз. Решение задач. 1 часть. 10 класс.Скачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Способы получения алканов. Электролиз водных растворов солей карбоновых кислот.Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

ХИМИЯ 11 класс : Электролиз растворовСкачать

Электролиз. Решение задач. 2 часть. 10 класс.Скачать

91. Электролиз. Задачи (часть 2)Скачать

