Составление схем гальванических элементов
Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[Al3+] = 0,0001 моль/л, [Аg+] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1 = Ag0
Видео:Разбор схемы гальванического элементаСкачать

Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Al0 — 3 = Al3+
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Al0 + 3Ag+ = 3Ag0 + Al3+
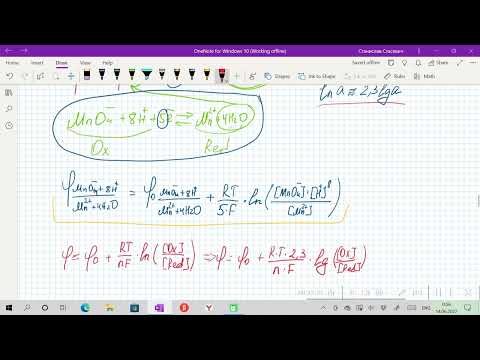
Для расчета значения потенциалов, используем уравнение Нернста:
Видео:Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Е = Е0 + (0,059/n)lgC где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Тогда
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 — (-1,74) = +2,48 B.
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Mg/Mg2+//Al3+/Al
Или
Mg/MgCl2//AlCl3/Al
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Al3+ + 3 = Al0
Видео:Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Mg0 — 2 = Mg2+
Cуммарное уравнение процесса:
3Mg0 + 2Al3+ = 3Mg2+ + 2Al0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag+ + Cl– = AgCl. Рассчитать стандартную ЭДС элемента при 25o C, Go и константу равновесия реакции.
Решение.
1. Схема гальванического элемента имеет вид:
Видео:Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Ag|AgCl|Cl–||Ag+|Ag
2. Электродные процессы:
Правый электрод: Ag+ +1 = Ag; Eo = +0,799 В;
Левый электрод: AgCl + 1 = Ag+ + Cl– ; Eo = +0,222 В;
Общая реакция: Ag+ + Cl– = AgCl; Eo = +0,557 В.
Видео:Гальванический элементСкачать

3. Рассчитаем энергию Гиббса процесса:
Для расчета Go используем формулу:
Go = —nFEo, где
n — количество электронов, участвующих в процессе, 1 электрон; F — универсальная газовая постоянная, 96485 Кл.моль-1; Eo — окислительно-восстановительный потенциал процесса, +0,557 В.
Тогда
Go = —nFEo = -(96485 Кл.моль-1) . (0,557 В) = -53,742 кДж. моль-1.
4. Расчет константы равновесия реакции:
Видео:Гальванические элементы. Практическая часть. 10 класс.Скачать

Для расчета используем формулу:
К = exp–Go/RT = exp[ -53,742/(8,31 . 298,15)] = 2,6 . 109
🔍 Видео
Составление схемы и вычисление ЭДС гальванического концентрационного элемента | Уравнение НернстаСкачать

Гальванический элементСкачать

Продукты в ОВР. Ч.2-3. Гальванический элемент.Скачать

Гальванические элементыСкачать
Гальванические элементы. 10 класс.Скачать

Гальванические элементы. 2 часть. 10 класс.Скачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТСкачать

Химия. Лекция 6. Часть 1. Решение задач на электродные потенциалы и электропроводность растворов.Скачать

Задачи по четырехполюсникам. П - образная схемаСкачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Электролиз. 10 класс.Скачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Уравнение НернстаСкачать