Как рассчитать концентрацию электролита, если известна степень диссоциации (degree of dissociation)
Задачав 76.
При какой концентрации СН3СООН диссоциирована на 30%?
Решение:
КD(CH3COOH) = 1,78 · 10-5;
α(СН3СООН) = 30% или 0,3;
СМ(СН3СООН) = ?
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (α · CM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
СМ(СН3СООН) = КD(CH3COOH) · [(1 — α(СН3СООН)]/[α(СН3СООН)]2 =
= [(1,78 · 10-5) · (1 — 0,3)]/(0,3)2 = [(1,78 · 10-5) — (5,34 · 10-6)]/0,09 =
= (1,246 · 10-5)/0,09 = 1,98 · 10-4 моль/дь3.
Ответ: 1,98 · 10–4 моль/дм3.
Задача 77.
При какой концентрации НСООН диссоциирована на 50%?
Решение:
КD(НCOOH) = 1,77 · 10-4;
α(НСООН) = 50% или 0,5;
СМ(НСООН) = ?
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (α · CM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
СМ(НСООН) = КD(НCOOH) · [(1 -α(НСООН)]/[α(НСООН)]2 =
= [(1,77 · 10-4) · (1 — 0,5)]/(0,5)2 = [(1,77 · 10-4) — (8,85 · 10-5)]/0,25 =
= (8,85 · 10-5)/0,25 = 3,54 · 10-4 моль/дь3.
Ответ: 3,60 · 10–4 моль/дм3.
Задача 78.
Определить молярность раствора NH2OH, если степень диссоциации раствора составляет 1,38 · 10-3.
Решение:
КD(NH2OH) = 9,67 ·10–7;
α(NH2OH) = 1,38 · 10-3;
СМ(NH2OH) = ?
Так как NH2OH является слабым электролитом, то константа диссоциации определяется по формуле:
KD = (α · CM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
СМ(NH2OH) = КD(NH2OH) · [(1 — альфа(NH2OH)]/[альфа(NH2OH)]2 =
= [(9,67 ·10–7) · (1 — 1,38 · 10-3)]/(1,38 · 10-3)2 = [(9,67 ·10–7) — (1,33 · 10-9)]/(1,9 · 10-6) =
= (9,66 · 10-7)/(1,9 · 10-6) = 5,1 · 10-1 М.
Ответ: 5,1 · 10–1 М.
Задача 79.
Определить молярность раствора HCN, если степень диссоциации раствора составляет 1,24 · 10-2.
Решение:
КD( HCN) = 7,90 · 10–10;
α( HCN) = 1,24 · 10-2;
СМ( HCN) = ?
Учитывая, что HCN является слабым электролитом, то константа диссоциации определяется по формуле:
KD = (α · CM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
СМ(HCN) = КD(HCN) · [(1 -α(HCN)]/[альфа(HCN)]2 =
= [(7,90 · 10–10) · (1 — 1,24 · 10-2)]/(1,24 · 10-2)2 = [(7,90 · 10–10) — (9,8 · 10-12)]/(1,54 · 10-4) =
= (7,8 · 10-10)/(1,54 · 10-4) = 5,1 · 10-6 М.
Ответ: 5,1 · 10–6 М.
💡 Видео
Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

Задачи на концентрациюСкачать
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])Скачать
![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)
Молярная концентрация. 10 класс.Скачать

Задачи на степень диссоциации.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Константа гидролиза и pH водного раствора солиСкачать

Решение задач на концентрации растворовСкачать

Диссоциация. Гидролиз солей. pHСкачать
Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])Скачать
![Константа основности (Кb) и рН для слабых кислот pH=14-1/2(lgKb-lg[B])](https://i.ytimg.com/vi/0qTq4bM0zHk/0.jpg)
Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Урок 76 (осн). Задачи на вычисление мощностиСкачать

Вычисление рН в растворах солейСкачать

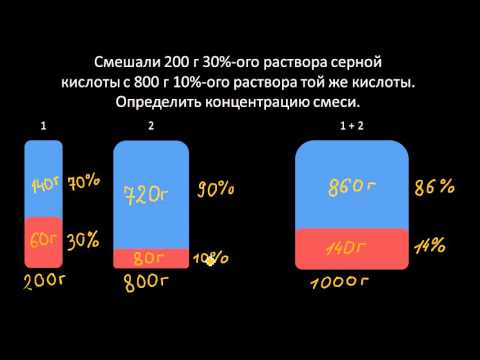
Математика Задачи на концентрацию и растворыСкачать

Сильные и слабые электролиты. Константа диссоциации. Водородный показатель.Скачать

Нормальная концентрация раствора. Нормальность (Сн). Решение задач.Скачать

