Последовательность заполнения электронных энергетических уровней и подуровней атомов элементов
Задача 20.
Каким принципам подчиняется последовательность заполнения электронных энергетических уровней и подуровней? Ответ иллюстрируйте примерами
Решение:
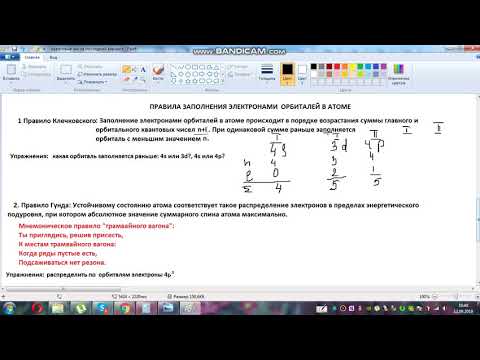
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по атомным орбиталям, при котором энергия атома минимальна. Поэтому они заполняются в порядке последовательного возрастания их энергий. Этот порядок заполнения определяется правилом Клечковского (правило n + l ):
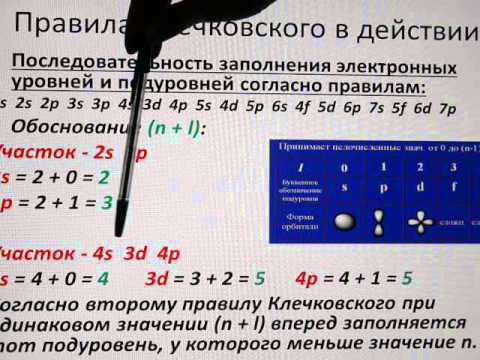
– заполнение электронных подуровней с увеличением порядкового номера атома элемента происходит от меньшего значения (n + l) к большему значению (n + l );
– при равных значениях (n + l) заполняются сначала энергетические подуровни с меньшим значением. Последовательность заполнения энергетических уровней и подуровней следующая:
1s►2s►2р►3s►3р►4s►3d►4р►5s►4d►5р►6s►(5d1)►4f►5d►6р►7s►(6d1-2)►5f►6d►7р
Поэтому, например, в атоме элемента скандия Sc после заполнения 4s-орбиталей заполняются
3d-орбитали, а не 4р:
1s2 2s2 2p6 3s2 3p6 4s2 3d1
Электронные формулы элементов все же иногда пишут, используя нумерацию уровней и орбиталей. Тогда электронная формула Sc будет имееть вид:
1s2 2s2 2p6 3s2 3p6 3d1 4s2
Таким образом, правила Клечковского илюстрируют последовательность заполнения электронных энергетических уровней и подуровней. Првильно составлять электронную формулу атома элемента с использованием правил Клечковского.
Задача 21.
Напишите электронные формулы атомов марганца и селена. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Решение:
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элементов №25 (марганец) – d-элемент и №34 (селен) – p-элемент электронные формулы согласно правилам Клечковского имеют вид:
25Mn 1s2 2s2 2p6 3s2 3p6 4s2 3d5;
34Se 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4.
📸 Видео
Квантовые числа. Принцип Паули, правило Гунда (Хунда) и правило Клечковского. 2 часть. 10 класс.Скачать

100. Правила КлечковскогоСкачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Как решать 1 задание из ЕГЭ по химии "Электронная конфигурация атома"Скачать

Квантовые числа. 1 часть. 10 класс.Скачать

Движение электронов в атоме. 1 часть. 8 класс.Скачать

11. Строение атома. Квантовые числаСкачать

Тема 1.4 Часть 2: Правило КлечковскогоСкачать

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

11 класс.Элементы 4 периода.Электронные формулы.Скачать

Электронные формулы атомов (теория). Правила Клечковского, Хунда, принцип ПаулиСкачать
Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

Электронные конфигурации атомов. Химия – простоСкачать

В помощь школьнику : правила заполнения атомных орбиталейСкачать
ХИМИЯ ПРОСТО — Электронная конфигурация атомаСкачать

Электронные конфигурации | Химия ЕГЭ | УмскулСкачать

Квантовые числа (видео 14) | Квантовая физика | ФизикаСкачать

Метод молекулярных орбиталей. Часть 1. Основные понятия.Скачать
СТАРТ КУРСА «ХимФак 2023» | 1 урок | Строение атома | Екатерина Строганова | 100балльный репетиторСкачать

