Задачи по химии на вычисление осмотического давления раствора
Задача 463.
Чему равно осмотическое давление 0,5 М раствора глюкозы С6Н12О6 при 25°С?
Решение:
Согласно уравнению Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Д ж/(моль . К)], T – температура.
Рассчитаем осмотическое давление:
Р = 0,5 .8,314 . 298 = 1238,786 кПа = 1,24 МПа.
Ответ: 1,24 МПа.
Задача 464.
Вычислить осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г Н2О при 293 К. Плотность раствора считать равной единице.
Решение:
M(С12Н22О11) = 342 г/моль. Для расчётов используем уравнение Р = СМRT, СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура. СМ можно выразить через массу растворённого вещества (m) и его мольную массу (М). Массу сахара, содержащегося в 1000 мл раствора, найдём из пропорции:
Отсюда
Видео:Осмос и осмотическое давлениеСкачать

Ответ: 325 кПа.
Задача 465.
Сколько граммов глюкозы С6Н12О6 должно находиться в 0,5 л раствора, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 л которого содержится 9,2 г глицерина С3Н5(ОН)3?
Решение:
М(С6Н12О6) = 180г/моль, М[С3Н5(ОН)3] = 92г/моль. Осмотическое давление определяется по формуле: Р = СMRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура. Из данного уравнения вытекает, что осмотическое давление растворов зависит от концентрации и температуры.
Таким образом, осмотическое давление двух растворов будет одинаковым, если концентрации растворённых веществ будут одинаковыми при одной и той же температуре. Поэтому справедливо равенство:
Р(С6Н12О6) = Р[С3Н5(ОН)3]; СМ(С6Н12О6)RT = СМ[С3Н5(ОН)3]RT
Находим молярную концентрацию глицерина:
Теперь рассчитаем, сколько граммов глюкозы содержится в 0,5 л 0,1М раствора по формуле:
где СМ, m(B), M(B) и V(мл) соответственно молярная концентрация, масса, молярная масса растворённого вещества и объём раствора.
Ответ: 9 г.
Задача 466.
К 100 мл 0,5М водного раствора сахарозы добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25°С?
Решение:
M(С12Н22О11) = 342 г/моль.
Для расчёта массы С12Н22О11 используем формулу:
Видео:Осмос и осмотическое давлениеСкачать

Рассчитаем молярную концентрацию полученного раствора сахарозы, находим:
Осмотическое давление полученного раствора находим из формулы: P = CMRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], Т – температура.
Тогда
P = 0,125 . 8,314 . 298 = 309,7 кПа.
Ответ: 309,7 кПа.
📽️ Видео
Осмотическое давление.Скачать

Осмотическое давлениеСкачать

Осмос - что такое и как он влияет на клеткиСкачать

Урок 466. Методы регистрации элементарных частиц (часть 2)Скачать

задачи на коллигативные свойстваСкачать

I Осмотическое давление IСкачать
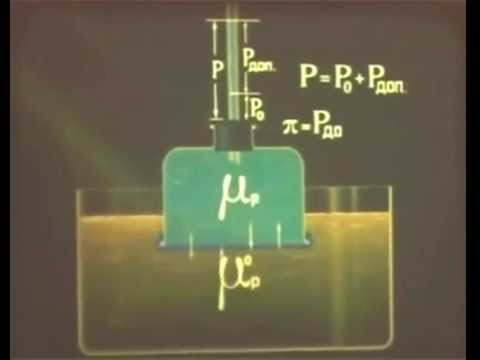
3 6 Осмос Коллигативные свойства растворовСкачать

Физика. Решение задач на тему "Давление и сила давления"Скачать

Урок 52 (осн). Задачи на гидростатическое давление - 3Скачать

Коллигативные свойства растворов. Законы РауляСкачать

Коллигативные свойства растворовСкачать
Решение задач на тему: "Правило Вант-Гоффа". 1 часть. 10 класс.Скачать

Осмос. Химический сад. Химия – простоСкачать

Давление в жидкостях и газах. Закон Паскаля. Практическая часть. 7 класс.Скачать

Урок 48 (осн). Задачи на гидростатическое давление - 1Скачать

Урок 57 (осн). Задачи на атмосферное давлениеСкачать

Осмос (видео 4) | Мембранный транспорт | БиологияСкачать

Гидростатическое давление. Практическая часть. 7 класс.Скачать

