Вычисление концентрации электролита по значению его рН
Задача 545.
Чему равна концентрация раствора уксусной кислоты, рН которого равен 5,2?
Решение:
KD(CH3COOH) = 1,8 . 10-5.
Согласно условию задачи -lg[H+] = 5,2. Следовательно, -lg[H+] = 5,2 = 6,8. По таблице логарифмов находим:
[H+] = 6,31 . 10-5 моль/л.
Концентрации ионов [H+] и ионов [CH3COO—] в растворе CH3COOH равны:
CH3COOH ⇔ CH3COO— + H+
Обозначим искомую концентрацию уксусной кислоты через x и найдём его значение из выражения константы диссоциации, получим:
Ответ: CM = 2,2 . 10-7 моль/л.
Задача 546.
Вычислить значения (OH—) и p(OH) в 0,2 н. растворе NaОН, считая f(OH—) = 0,80.
Решение:
Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: I(NaOH) = 0,20. При ионной силе равной 0,2 и при коэффициенте активности иона равному 0,80 можно рассчитать значения активностей ионов по формуле (ион) = fCM, получим:
(OH—) = 0,80 . 0,20 = 0,16 моль/л.
Теперь рассчитаем значение p(OH—):
p(OH—) = -(OH—) = -lg1,6 . 10-1 = 1 — lg1,6 = 0,8.
Ответ: p(OH-) = 0,8, (OH—) = 1,6 . 10-1 моль/л.
Задача 547.
Используя данные табл. 7 приложения, найти p(H+) 0,005 н. раствора НСI, содержащего, кроме того, 0,015 моль/л NаС1.
Решение:
Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: I = 0,005 + 0,015 = 0,02.
При этой ионной силе коэффициент активности однозарядного иона равен 0,90. Активную концентрацию иона водорода рассчитаем по формуле (ион) = fCM, где f — коэффициент активности иона, СМ – концентрация раствора, получим:
(H+) = 0,02 . 0,9 = 1,8 . 10-2 моль/л.
Теперь находим значение p(H+):
p(H+) = -(H+) = -lg1,8 . 10-2 = 2 — lg1,8 = 2 — 0,255 = 1,75.
Видео:Как считать процент концентрации раствораСкачать

Ответ: p(H+) = 1,75.
Задачи 548.
Степень диссоциации слабой одноосновной кислоты в 0,2 н. растворе равна 0,03. Вычислить значения [H+], [OH—] и pOH для этого раствора.
Решение:
Находим концентрацию ионов водорода:
[H+] = . CM = 0,2 . 0,03 = 6 . 10-3 моль/л.
Концентрацию гидроксид-ионов находим из соотношения:
pH2O = [H+] . [OH—] = 10-14; [OH—] = (10-14)/(6 . 10-3) = 1,7 . 10-12.
Отсюда
pОН = lg[OH—] = -lg1,7 . 10-12 = 12 — lg1,7 = 12 — 0,23 = 11,77.
Ответ: [H+] = 6 . 10-3 моль/л; [OH—] = 1,7 . 10-12; pОН = 11,77.
📹 Видео
Молярная концентрация. 10 класс.Скачать

Способы выражения концентрации растворов. 8 класс.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Решение задач на концентрации растворовСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Нормальная концентрация раствора. Нормальность (Сн). Решение задач.Скачать

Задачи на концентрациюСкачать
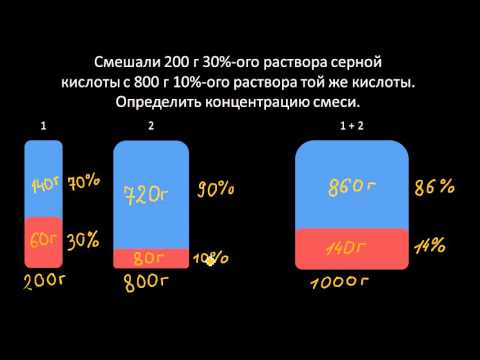
Задача на Молярную концентрацию с порциями раствора.Скачать

Коллигативные свойства растворовСкачать
Успеть за 300 секунд, #10: Молярная концентрация (молярность)Скачать

Задача на приготовление растворов методом "КРЕСТА". Включает См и массовую долю р-ров.Скачать

№ 548 - Алгебра 9 класс МерзлякСкачать
Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

Задача на расчет молярной концентрации (См) по схемам ОВР + титрование.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролиз. Решение задач. 1 часть. 10 класс.Скачать

Задача на произведение растворимости ПР=[Ag+]2[CrO4(2-)]Скачать
![Задача на произведение растворимости ПР=[Ag+]2[CrO4(2-)]](https://i.ytimg.com/vi/lBMm8M_2ndI/0.jpg)
Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

