Составление электронных и молекулярных уравнений реакций. Уравнение Нернста (Nernst)
Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
Задание 241.
В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Стандартные электродные потенциалы цинка, меди и серебра соответственно равны -0,76 В, +0,34 В и +0,80 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка:
Электронные уравнения процесса:
Zn0 + Cu2+ = Zn2+ + Cu0
Молекулярное уравнение процесса:
Zn + CuSO4 = ZnSO4 + Cu
Серебро, имея более электроположительный потенциал, чем медь не способно вытеснять ионы меди из сульфата меди, поэтому раствор медного купороса, с опущенной в него серебряной пластинкой, не обесцвечивается.
Задание 242.
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы цинка и меди соответственно равны -0,76 В и +0,34 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка, а цинковая пластинка будет уменьшаться по массе:
Электронные уравнения процесса:
Zn0 + Cu2+ = Zn2+ + Cu0
Молекулярное уравнение процесса:
Zn + CuSO4 = ZnSO4 + Cu
б) Так как стандартный электродный потенциал цинка (-0,76 В) больше, чем стандартный электродный потенциал магния (-2,36 В), то цинк не способен вытеснять магний из растворов его солей, поэтому цинковая пластинка останется без изменений.
в) Так как стандартный электродный потенциал цинка (-0,76 В) меньше, чем у свинца (-0,13 В), то металлический цинк будет обладать большими восстановительными способностями чем ионы Pb2+, и реакция будет протекать с растворением цинковой пластинки, т. е. её масса будет уменьшаться.
Электронные уравнения процесса:
Zn0 + Pb2+ = Zn2+ + Pb0
Молекулярное уравнение процесса:
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
Задание 243.
При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
Решение:
Найдём значение электродного потенциала цинка в растворе его соли:
— стандартный электродный потенциал цинка.
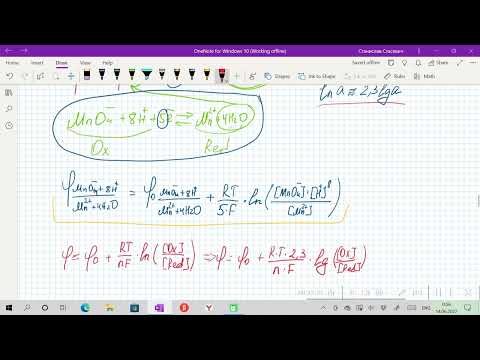
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов цинка в растворе:
Ответ: 0,30 моль/л.
Задание 244.
Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами:
а); AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы кадмия и серебра соответственно равны -0,403 В и +0,80 В. Исходя из того, что кадмий имеет более электроотрицательный потенциал, чем серебро, то между кадмием и нитратом серебра проходит реакция (кадмий вытесняет серебро из соли), и кадмиевая пластинка при этом будет уменьшаться по массе.
Электронные уравнения процесса:
Cd0 + 2Ag+ = Cd2+ + 2Ag0
Молекулярное уравнение процесса:
Cd + 2 АgNO3 = Cd(NO3)2 + 2Ag
б) Так как стандартный электродный потенциал кадмия (-0,403 В) больше, чем стандартный электродный потенциал цинка (-0,76 В), то кадмий не способен вытеснять цинк из растворов его солей, поэтому кадмиевая пластинка останется без изменений.
в) Так как стандартный электродный потенциал кадмия (-0,403 В) меньше, чем у никеля (-0,25 В), то металлический кадмий будет обладать большими восстановительными способностями чем ионы Ni2+, и реакция будет протекать с растворением кадмиевой пластинки, т. е. её масса будет уменьшаться.
Электронные уравнения процесса:
Cd0 + Ni2+ = Cd2+ + Ni0
Молекулярное уравнение процесса:
Cd + NiSO4 = CdSO4 + N
Задание 245.
Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn2+ (моль/л). Ответ. 1,89 . 10-2 моль/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn2+ в растворе:
Ответ. 1,89 . 10-2 моль/л.
🔍 Видео
4 3 Электрохимический потенциалСкачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Уравнение НернстаСкачать
Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Урок 230. Простейшие задачи на электрический потенциалСкачать

Решение задач по электростатике. Интенсив 2024Скачать

Зависимость электрического сопротивления металлов от температуры. Сверхпроводимость. 8 класс.Скачать

Физика8 класс. §45 Расчёт сопротивления проводника. Удельное сопротивлениеСкачать

Урок 242. Задачи на электроемкостьСкачать

Урок 240. Простейшие задачи на электроемкостьСкачать

Закон электромагнитной индукцииСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Урок 233. Задачи на электрический потенциал - 1Скачать

Урок 220. Задачи на напряженность электрического поля - 2Скачать

