Расчет эквивыалента и молярной массы эквивалента кислоты или соли
Эквивалент, молярная масса эквивыалента хромовой кислоты
Задача 125.
1. Вычислить эквивалент и эквивалентную массу металла в соединении: H2CrO4.
2. Вычислить эквивалент и молярную массу эквивалента соединения, указанного в предыдущей задаче. Сколько эквивалентов содержится в одном моле этого соединения?
3. Чему равен эквивалент кислоты, основания и соли в нижеприведенных реакциях:
Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O;
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O.
Решение:
1. Фактор эквивалентности хрома равен 1/6 (валентность хрома равна 6); молярная масса эквивалентов хрома равна М (Cr)/6.
2. Молярная масса эквивалентов H2CrO4 равна М (H2CrO4)/2 (H2CrO4 — двухосновная кислота); один моль H2CrO4 содержит 2 эквивалента.
3. Эквивалент (equivalent) сложного вещества, как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию вступает это вещество.
В реакции: Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O фактор эквивалентности H2SO4, т.е. МЭ(H2SO4)/2 = 98/2 = 49 г/моль равен даум — кислота в данной реакции проявляет основность равную двум; фактор эквивалентности Al(OH)3 равен 1/3, т.е. МЭ(Al(OH)3)/3 = 26 г/моль — кислотность Al(OH)3 в данной реакции равна 3; фактор эквивалентности соли Al2(SO4)3 равен 1/6, т.е. МЭ[Al2(SO4)3]/6 = 342/3 = 57 г/моль — алюминий в данной соли проявляет степень окисления +3 и содержится в количестве двух атомов.
В реакции: Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O фактор эквивалентности H2SO4, т.е. МЭ(H2SO4)/12 = 98/1 = 49 г/моль равен единице — кислота в данной реакции проявляет основность равную единице; фактор эквивалентности Al(OH)3 равен 1/3, т.е. МЭ(Al(OH)3)/3 = 26 г/моль — кислотность Al(OH)3 в данной реакции равна 3; фактор эквивалентности соли Al(HSO4)3 равен 1/3т.е. МЭ[Al(HSO4)3]/3 = 318/3 = 106 г/моль — алюминий в данной соли проявляет степень окисления +3 и содержится в единственном числе.
Расчет количества вещества
Задача 126.
Рассчитайте определение количества вещества меди и никеля, приходящихся на 25 кг мельхиора.
Решение:
М(Cu) = 63,546 г/моль;
М(Ni) = 58,6934 г/моль.
Мельхиор — это сплав 75 % меди и 25 % никеля с незначительными добавками марганца.
1. Рассчитаем массу меди, получим:
m(Cu) = w%(Cu) . m(мельхиор) = 0,75 . 25 = 18,75 кг или 18750 г.
Видео:Расчет молярной массы эквивалентовСкачать

2. Рассчитаем массу никеля, получим:
m(Ni) = w%(Ni) . m(мельхиор) = 0,25 . 25 = 6,25 кг или 6250 г.
3. Рассчитаем количество меди, получим:
n(Cu) = m(Cu)/M(Cu) = 18750 г/63,546 г/моль = 295,06 моль
4. Рассчитаем количество никеля, получим:
n(Ni) = m(Ni)/M(Ni) = 6250 г/58,6934 г/моль = 106,48 моль.
Расчет массы образовавшихся вещест при реакции
Видео:133. Эквивалент. Молярная масса эквивалента.Скачать

Задача 127.
При взаимодействии 12 г нитрата серебра с соляной кислотой образовался осадок. Рассчитайте массы всех образовавшихся веществ, если массовая доля примесей в нитрате серебра состовляет 4%.
Решение:
m(обр.) = 12 г;
w%(примеси) = 4% = 0,04;
M(AgNO3) = 169,87 г/моль;
M(HNO3) = 63,01 г/моль;
M(AgCl) = 143,32 г/моль.
Уравнение реакции имеет вид:
AgNO3 + HCl = AgCl + HNO3
ИЗ уравнения вытекает, что из 1 моль AgNO3 образуется по 1 моль AgCl и HNO3. Значит, n(AgNO3) = n(AgCl) = n(HNO3).
1. Рассчитаем массу AgNO3, получим:
m(AgNO3) = m(обр.) . 1 — w%(примеси) = = 12 . (1 -0,04) = 11,52 г.
2. Рассчитаем количество AgNO3, получим:
Видео:Эквивалент. Часть 1. Эквивалент элемента. Задачи.Скачать

n(AgNO3) = m(AgNO3)/M(AgNO3) = 11,52/169,87 = 0,0678 моль.
n(AgNO3) = n(AgCl) = n(HNO3) = 0,0678 моль.
3. Рассчитаем массу AgCl, получим:
m(AgCl) = n(AgCl) . M(AgCl) = 0,0678 . 143,32 = 9,71 г.
4. Рассчитаем массу HNO3, получим:
m(HNO3) = n(HNO3) . M(HNO3) = 0,0678 . 63,01 = 4,27 г.
Овет: m(AgCl) = 9,71 г; m(HNO3) = 4,27 г.
📺 Видео
ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Эквивалент. Часть 2. Эквивалент сложного в-ва: оксидов, оснований, кислот, солей.Скачать

Эквивалент и закон эквивалентовСкачать

Химический эквивалент и фактор эквивалентности в реакциях ионного обменаСкачать

Молярная масса. 8 класс.Скачать

Эквиваленты Закон эквивалентовСкачать

Экспериментальная часть лабораторной работы № 1 Определение молярной массы эквивалента металлаСкачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Как применять закон эквивалентов в решении задачСкачать

Решение задач на эквивалентыСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

ЭквивалентСкачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Эквивалент. Часть 4. Задачи на эквивалент в окислительно-восстановительных реакциях.Скачать

Определение молярной массы эквивалента металла методом вытеснения водородаСкачать

Химический эквивалентСкачать
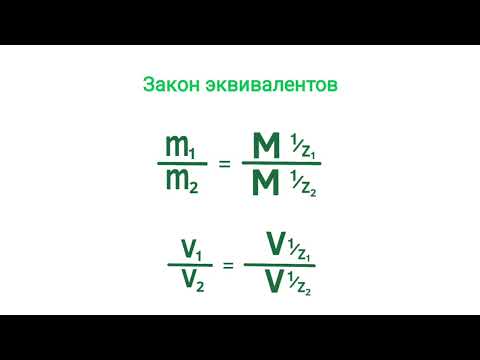
132. Фактор эквивалентности. Число эквивалентности.Скачать

