Задача 128.
Какую навеску кальцита, содержащего CaСО3 (w% = 60%), нужно взять для анализа, чтобы на титрование её израсходовать 15,00 см3 раствора НСl с титром 0,003820 г/см3?
Решение:
w%(CaСО3) = 60%;
V(HCl) = 15,00 см3;
T(HCl) = 0,003820 г/см3;
a(CaСО3) = ?
Уравнение реакции:
CaCO3 + 2HCl ⇔ CaCl2 + H2O + CO2.
HCl – титрант (В); CaCO3 – определяемое вещество (А). М(CaCO3) = 100 г/моль;
Э(CaCO3) = 50 г/моль.
- 1. Рассчитаем массу карбоната кальция, содержащегося в навеске образца
- 2. Расчет навески вещества
- Обратное титрование
- 1. Расчет массы определяемого вещества в навеске образца
- 2. Расчет массовой доли определяемого вещества в навеске пробы
- Титрование раствора буры
- 1. Расчет нормальности раствора титранта
- 2. Вычисление титра раствора HCl
- 📽️ Видео
1. Рассчитаем массу карбоната кальция, содержащегося в навеске образца
Массу CaCO3 рассчитаем по формуле:
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

m(А) = [V(В) · Т(В) · Э(А)]/Э(В), где
V(В) — объем раствора титранта; Т(В) — титр раствора, см3; Э(А) — эквивалентная масса определяемого вещества; Э(В) — эквивалентная масса титранта.
Тогда
m(CaCO3) = [V(HCl) · Т(HCl) · Э(CaCO3)]/Э(HCl) =
= (15 · 0,003820 · 50)/36,46 = 0,0786 г.
2. Расчет навески вещества
Навеску кальцита рассчитаем по формуле:
w% = (m · 100%)/a, где
m — масса определяемого вещества (А), г; a — навеска вещества, г
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Тогда
а = (m · 100%)/w%;
a(CaСО3) = [m(CaCO3) · 100%]/w%(CaСО3) =
= (0,0786 · 100)/60 = 0,1311 г
Ответ: a(CaСО3) = 0,1311 г.
Обратное титрование
Задача 129.
Навеску карбоната натрия 0,1054 г обработали 25,00 см3 0,20 М раствора HCl. Избыток кислоты оттитровали 25,40 см3 0,12 М раствора NaOH. Вычислите содержание Na2СО3 в исходном образце (w, %).
Решение:
a(Na2CO3) = 0,1054 г;
V(HCl) = 25,00 см3;
Э(Na2CO3) = 53 г/моль;
CM(HCl) = 0,20 М;
V(NaOH) = 25,40 см3;
CM(NaOH) = 0,12 М;
w%(Na2CO3) = ?
Уравнения реакци:
Na2CO3 + 2HCl > 2NaCl + H2O + CO2;
NaOH + HCl = NaCl + H2O
Видео:Определение массовых долей элементов в соединениях. 8 класс.Скачать

Определяемое вещество (А) – Na2CO3; М = 106 г/моль; Э(Na2CO3) = 53 г/моль. Титранты: HCl (B1) и NaOH (В2), их молярные концентрации равны нормальным.
1. Расчет массы определяемого вещества в навеске образца
Массу (m) CaO определяем по формуле:
m(A) = [CH(B1)V(B1) — CH(B2)V(B2)]Э(А)/1000, где
CH(B1) — нормальность раствора первого титранта; CH(B2) — нормальность раствора второго титранта; V(B1) — объем раствора первого титранта; V(B2) — объем раствора второго титранта; Э(А) — эквивалентная масса определяемого вещества.
Тогда
m(Na2CO3) = [CH(HCl)V(HCl) — CH(NaOH)V(NaOH)]Э(А)/1000 = (0,20 · 25,00) — [(0,12 · 25,40)]53/1000 = 0,1035 г.
2. Расчет массовой доли определяемого вещества в навеске пробы
Массовую долю Na2CO3 в навеске карбоната натрия, рассчитаем по формуле:
Видео:Массовая доля элементаСкачать

w% = (m · 100%)/a, где
а — навеска вещества; m — масса определяемого вещества.
Тогда
w%(Na2CO3) = (0,1035 · 100%)/0,1054 = 98,20%.
Ответ: w%(Na2CO3) = 98,20%.
Титрование раствора буры
Задача 130.
Вычислите нормальную концентрацию и титр раствора HCl, если на титрование буры массой 0,4217 г израсходовано 17,50 см3 кислоты.
Решение:
а(Na2B4O7 · 10H2O) = 0,4217 г;
V(HCl) = 17,50 см3;
Э(Na2B4O7 · 10H2O) = 190,685 г/моль
CН(HCl) = ?
Т(HCl) = ?
Определяемое вещество (А) – Na2B4O7 · 10H2O; М = 381,37 г/моль; Э = 190,685 г/моль. Титрант: HCl
Видео:Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Уравнение реакции имеет вид:
Na2B4O7 · 10H2O + 2HCl ⇔ 2NaCl + 4H3BO3 + 5H2O.
1. Расчет нормальности раствора титранта
Для рассчета нормальности раствора HCl используем формулу:
m(A) = [CH(B) · V(B) · Э(А)]/1000, где
CH(В) — нормальность раствора титранта; Э(А) — эквивалентная масса определяемого вещества; V(B) — объем раствора титранта.
Тогда
CH(B) = [m(A) · 1000]/[V(B) · Э(А)];
CH(HCl) = [m(Na2B4O7 · 10H2O) · 1000]/[V(HCl) · Э(Na2B4O7 · 10H2O)] = (0,4217 · 1000)/(17,50 · 190,685) = 0,1264 моль/дм3.
2. Вычисление титра раствора HCl
Видео:Определение концентрации вещества в растворе методом титриметрииСкачать

Титр раствора кислоты определим из формулы:
СН(В) = [T(В) · 1000]/Э(В), где
T(В) — титр раствора титранта; Э(В) — эквивалентная масса титранта; СН(В) — нормальность раствора титранта.
Тогда
T(В) = [СН(В) · Э(В)]/1000;
Т(HCl) = [СН(HCl) · Э(HCl)]/1000 = (0,1264 · 36,46)/1000 = 0,004609 г/см3.
Ответ: CH(HCl) = 0,1264 моль/дм3; Т(HCl) = 0,004609 г/см3.
📽️ Видео
ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

Вычисление массовой доли элементов в веществеСкачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Задачи на массовую долю | Химия ЕГЭ для 10 класса | УмскулСкачать

Определение массовых долей элементов в соединениях. Практическая часть. 8 класс.Скачать

Поиск формулы вещества по массовым долям элементовСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ. Часть 1.Скачать

19. Выведение формулы вещества по массовым долям элементовСкачать

Титр раствора (Т). Решение задач. Часть 1.Скачать

8 класс - Химия - Определение формулы вещества по массовым долям элементаСкачать

Как найти молекулярную массуСкачать
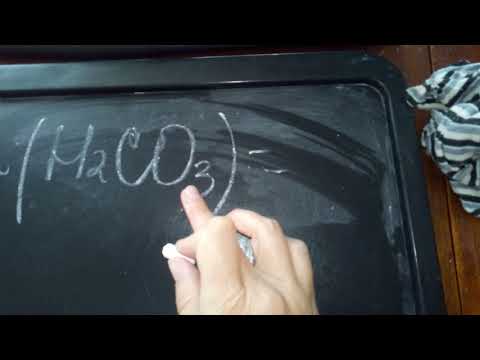
Химия | Относительная атомная и молекулярная массаСкачать

Условный Титр раствора или Титр по определяемому веществу. Часть 2.Скачать

